The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
별 불가사리(Asterina pectinifera) 바이오차의 수용액 내 중금속(Pb, Cu, Zn, Cd) 흡착특성 및 적용성 평가
Abstract
Objectives
Heavy metals caused by industrialization have affected human society for several decades. Because of their toxicity for humans, lots of heavy metal treatments have been developed. However, many of those treatments have economic considerations and environmental disadvantages. This work explored an experimental assessment of adsorption of heavy metals using starfish (SF) biochar through quantitative and qualitative characterization and batch-tests.
Methods
Biochar (NACSF) was produced at 300℃ for 2 h in anaerobic conditions. The NACSF was characterized with XRD, XRF, FT-IR, SEM-EDX and elemental analyses. Moreover, batch-tests for each heavy metal using NACSF were conducted with ICP-OES analyses in order to evaluate the adsorption characteristics.
Results and Discussion
Based on the characterization results, the NACSF consisted of carbon and CaCO3 mainly. The adsorption rates of Pb, Cu, Zn and Cd decreased in the following order: Pb≫Cu>Zn≥Cd. Moreover, the Langmuir equation fit all adsorption data better than the Freundlich equation. Also, due to the alkalinity of NACSF, the measured pH values of all experimental groups were approximately 7~8.
Conclusions
The NACSF treatment was the most effective for Pb removal and it was determined that precipitation and surface adsorption were the most likely mechanisms for Pb removal. Thus, NACSF derived from starfish could be an cost-effective and eco-friendly treatment for heavy metal contaminated wastewater.
Key words: Adsorption, Starfish, Biochar, CaCO3, Heavy Metals
요약
목적
중금속은 수계에 유출 시 다양한 생물체에 영향을 미치며 최종적으로 인체 내에 축적되어 지속적인 건강손상을 초래한다. 이에 많은 중금속 처리법이 개발되었으나 처리비용 및 비환경적 문제에 따라 이를 보완하는 연구가 필요한 실정이다. 따라서 본 연구는 국내에 서식하는 불가사리(Asterina pectinifera, SF)를 이용해 바이오차를 제조한 후 분석 장비를 이용한 정성, 정량적 특성평가 및 Batch-Test를 통해 수용액 내 중금속의 처리 적용성을 판단하였다.
방법
불가사리를 무산소 조건에서 7℃/min로 승온온도를 조절하여 300℃로 2시간 유지시켜 바이오차(NACSF)를 제조한 후 특성평가를 위해 XRD, XRF, FT-IR, SEM-EDX, 원소분석기 등을 사용했으며, NACSF의 중금속별 Batch-Test 후 용액을 ICP-OES로 농도분석을 통하여 처리 특성을 평가하였다.
결과 및 토의
SF와 NACSF의 특성평가 결과 탄소와 CaCO3가 주성분임을 확인하였으며 Pb, Cu, Zn, Cd 각각 10 mg/L의 중금속 폐수를 제조하여 NACSF를 적용한 결과 흡착량은 Pb≫Cu>Zn≥Cd 순을 따르는 것으로 확인되었으며, 흡착등온식은 Langmuir 모델에 적합하였다. 또한 CaCO3에 의한 알칼리도 상승으로 모든 실험구에서 pH는 7~8로 측정되었다.
결론
NACSF는 Pb으로 오염된 수용액에 가장 적합한 것으로 보였으며 알칼리도로 인한 pH중화 효과로 흡착과 침전이 상호적으로 일어난 것으로 판단된다. 따라서 NACSF는 경제적이며 친환경적으로 다양한 영역에서 활용될 것으로 예상된다.
주제어: 흡착, 불가사리, 바이오차, 탄산칼슘, 중금속
1. 서 론
과거부터 현대에 이르기까지 인간의 산업 활동으로 인한 다량의 유해한 폐기물들이 필수 불가결하게 생성되고 있는 실정이다. 이에 생성되는 물질 중 중금속은 비중 4.5 이상인 금속류로 납(Pb), 카드뮴(Cd), 구리(Cu), 수은(Hg) 니켈(Ni), 아연(Zn) 등을 포함하는 물질이다. 중금속은 유기오염물질과 달리 생분해(biodegradation) 되지 않아 적절한 처리가 이루어지지 않은 상태로 수계로 유입 시 다양한 생물체에 영향을 미치며, 종류에 따라 오랜 기간 동안 인간의 장기 내에 머물러 급성 및 만성중독으로 일시적이거나 지속적인 건강손상을 야기시킬 수 있다[ 1]. 중금속 오염폐수는 현재 응집・침전법, 이온교환법, 흡착법 등 다양한 처리방법이 개발되어져 있다. 이중 응집・침전법은 타 공법에 비해 경제적이고 단순한 공정으로 고농도의 중금속을 저농도로 손쉽게 처리할 수 있다는 장점이 있어 널리 쓰이고 있으나, 중금속의 완전한 제거는 어려울 뿐만 아니라 다량의 화학약품 사용에 의한 비환경적인 문제와 처리 후 발생하는 저밀도의 슬러지로 인한 탈수의 필요 등 2차 처리가 필요하다는 단점을 가진다[ 2]. 또한 이온 교환법은 고체의 표면에 관능기를 보유한 이온교환수지와 이온을 당량적으로 상호 교환하는 방법으로 높은 이온교환 및 흡착 성능에 의한 효율적인 중금속 처리를 기대할 수 있으나, 대부분의 이온교환수지는 고가이며 석유로부터 생산되는 합성 이온교환 수지의 경우 난분해성으로 인해 환경문제가 발생한다[ 3, 4]. 따라서 기술한 문제의 개선을 위한 연구가 필요한 실정으로 최근 중금속 흡착제로서 다양한 종류의 바이오차(biochar)에 대한 연구가 진행 중에 있다[ 5]. 바이오차는 바이오매스(biomass)를 제한된 산소조건에서 250℃ 이상으로 열분해하여 제조한 것으로 가공 후 10~90%의 탄소와 인, 칼슘과 마그네슘 등의 유・무기물을 함유하며 탄소보유능이 뛰어난 탄소 중립적 물질로 주로 토양 개량제 및 복원제로 사용하고 있으며[ 5], 최근에는 이를 중금속으로 오염된 폐수에 적용한 흡착제로서 많은 연구가 이루어지고 있다[ 4, 6, 7]. 하지만 지금까지 바이오차를 흡착제로 이용 시 주로 탄소 함량이 높은 농업부산물의 바이오매스를 기반으로 한 한정적인 연구 경향을 보이고 있어 다양한 천연폐기물을 이용한 연구가 필요하다. 불가사리는 극피동물로 전세계에 1,700여 종, 국내에는 200여 종이 서식하고 있으며 이 중 우리나라 해안에는 주로 별 불가사리( Asterina pectinifera), 아무르불가사리( Asterias amurensis Lütken), 빨강불가사리( Certonardoa semiregularis), 거미불가사리( Ophioplocus japonicus) 등이 주로 서식한다고 알려져 있다[ 8]. 또한 잡식성종(Omnivore species)으로 어장의 물고기나 양식장의 어패류 등을 먹이로 하여 1마리 당 연간 5천 700마리 가량을 포식하는 왕성한 식욕과 하루 500만개의 알을 낳는 번식력을 가져 생태계를 교란시킬 뿐만 아니라 상대적으로 높은 칼슘성분의 함유에 따라 바다 바닥에 석화현상을 야기한다[ 8]. 이에 우리나라 수협에서는 매년 불가사리를 어민들을 통해 수매하는 실정이나 수매 후 처리방법이 마땅치 않은 것으로 알려져 있다[ 9]. 따라서 불가사리를 유・무기물이 복합된 천연폐기물로서 다양한 연구가 이루어질 시 친환경적, 경제적 부가가치를 산출할 것으로 기대된다. 하지만 현재 불가사리는 국내외에서 몇몇 토양개량제 및 안정화제 또는 이온교환을 위한 표면 흡착제의 담체로서 연구만 진행되었을 뿐 자체의 기능으로 폐수 내 중금속 처리에 대한 연구는 미흡하다[ 10- 12]. 따라서 본 연구는 불가사리를 기반으로 한 바이오차를 제조하여 중금속으로 오염된 폐수에 대한 흡착 적용성을 판단하기 위해 바이오차의 기초평가와 중금속 오염 폐수를 대상으로 흡착능을 평가를 하였으며 기기분석을 통해 흡착 메커니즘을 규명하여 불가사리 바이오차를 흡착제로서 적용 가능성을 제시하였다.
2. 재료 및 방법
2.1. 실험재료
본 실험에 사용한 불가사리(Starfish)는 별 불사사리( Asterina pectinifera, SF)로서 전라남도 여수시 인근 A섬으로부터 수집하여 실험실로 옮겨 3일 동안 흐르는 물에 담가 놓았다. 이것을 다시 증류수로 세척한 뒤 자연 건조시켜 믹서로 분쇄하였고, 10 mesh (2 mm) 체(sieve)를 이용하여 입경을 구분한 후 10 mesh 이하 크기를 바이오차의 원료로 사용하였다( Fig. 1). 실험에 사용할 인공폐수는 중금속 폐수 내 주로 용해되어있는 Pb, Cu, Cd, Zn로 선정하였고 KANTO사의 1,000 mg/L standard solution, JCSS 등급의 표준용액으로 사용하여 각각의 중금속마다 1 L 용량플라스크에 2번 희석과정을 거친 10 mg/L의 단일용액으로 0.1 N-HCl용액과 0.1 N-NaOH으로 pH를 조절하여 실험을 진행하였다.
2.2. 열분해장치 및 가공
본 연구에서는 불가사리의 열분해를 위해 석영관으로 구성된 밀폐 전기로(Furnace, Scien Tec Co.)를 사용하였고, 전기로와 제조한 바이오차를 Fig. 2에 나타내었다. 밀폐 전기로는 크게 아르곤가스주입 장치, 석영관로, 압력조절펌프로 이루어져있으며 석영관은 길이 1,200 mm, 내경 46 mm, 두께 4 mm의 것을 사용하였다. 시료를 도가니에 뚜껑을 덮어 넣어 석영관에 밀어 넣은 후 펌프로 내부 압력을 1×10-2 torr 이하로 압력을 조정하였고, 이를 7℃/min의 승온 온도로 300℃까지 도달시켜 2시간 동안 유지시킨 후 제조과정이 끝날 때까지 고순도(99.99999%) 아르곤을 관에 100 cc/min로 공급하여 무산소조건을 조성하였다. 열분해 이후에는 상온이 될 때까지 석영관 내에서 방냉시켰고 이를 NACSF (Non Air Condition Starfish)라 명명하였다. 이후 모든 실험은 밀폐용기에 보관하여 진행하였다.
2.3. 특성평가
제조한 SF와 NACSF는 XRD (Malvern panalytical, X’Pert3 MRD)와 XRF (Thermo Fisher, ZSX Primus II)를 이용한 광물학적 형태와 산화물형태로서 무기원소 함량을 분석, FT-IR (Thermo Fisher, Nicolet 6700)을 이용한 작용기 분석과 FE-SEM (HITACHI, S-4800)를 이용해 표면의 형태를 조사하였다.
또한 공업분석(proximate analyze)을 위해 일반 전기로(Lab House, DY-6026)를 이용하여 다음 식 (1- 5)을 적용해 수득률(yield), 수분(moisture), 휘발분(mobile matter), 회분(ash), 고정탄소(resident matter)함량을 산출하였고[ 13, 14], 원소분석기(Thermofinnigan, FlashEA1112)를 이용한 유기원소분석, BET분석기(MicrotracBEL corp, BELSORP-mini II)를 이용한 비표면적 측정, pH미터기(Mettler Toledo, SevenCompact Duo S213)를 통해 SF와 NACSF의 pH를 측정하였다.
2.4. Batch-Test
흡착속도를 평가하기 위해 2 L 용량비커에 중금속별 각각 pH 3으로 조절한 2 L의 인공폐수와 10 g NACSF를 투입하여 20~23℃의 실내조건에서 교반기로 150 rpm으로 교반시키면서 24시간 동안 일정 시간 간격으로 수면에서부터 2 cm 이내의 상등액을 실린지를 이용해 약 5 ml씩 분취한 후 pore size가 0.45 um의 실린지 필터로 분석액을 채취하였다. 이를 ICP-OES (Pekin Elmer, DV-5700)로 분석 후 유사일차 반응속도식(pseudo-first-order kinetic model, 식 (6))과 유사이차반응속도식(pseudo-second-order kinetic model, 식 (7))에 대입하여 각각의 중금속 별 흡착속도를 구하였다. 여기서 qe는 평형흡착량, qt는 t시간 때의 흡착량(mg/g), k1과 k2는 각각의 흡착 상수이다.
최적 투입비를 선정하기 위해 300 ml 삼각플라스크에 NACSF를 무게를 달리하여 각각 pH를 3으로 조절한 인공폐수 100 ml와 함께 투입 및 밀봉 후 항온진탕기에서 24시간 동안 20℃, 150 rpm으로 진탕한 것을 즉시 실린지 필터로 여과하였다. 이를 위에 나타낸 동일한 방법으로 용액 내 잔류농도를 분석하였다. 이에 따른 제거율(R%, 식 (8))을 바탕으로 최적 투입비를 산정하였고 흡착제의 평형농도와 흡착량(q, 식 (9))에 관계를 도출하였다. 또한 위의 흡착 데이터를 Freundlich ( 식 (10)) 및 Langmuir ( 식 (11)) 흡착등온식에 적용시켜 모델 파라미터를 도출하였다.
식 (10)과 식 (11)에서 q는 흡착제 단위 g당 흡착된 피흡착제의 양(mg/g), C e는 평형상태에서 남아있는 오염물질의 농도(mg/L)이며 K와 1/n은 각각 오염물질에 대한 흡착능과 흡착강도, a, b는 흡착제의 최대흡착량(qm, mg/g)과 흡착상수(L/mg)이다.
또한 Langmur 등온흡착식에 경우 각각에 구한 상수로 분리계수(RL)를 산출해 흡착제로서 적합성을 판단하였다( 식 (12)).
3. 결과 및 고찰
3.1. SF, NACSF 특성 평가
열분해 전후의 광물학적 특성과 무기산화물 형태를 정량분석하기 위해 SF와 NACSF의 XRD, XRF 분석을 실시하였다( Fig. 3, Table 1). XRD 결과에 따르면 SF와 NACSF는 모두 동일하게 주 peak가 2θ 값 29.714, 39.810, 48.127, 49.063에서 나타나 [(Ca, Mg)CO 3, PDF# 43-0697]를 주성분으로 한 calcite임을 보였으며, XRF 분석결과 CaO형태가 주로 분포하며 열분해로 인해 함량이 86.00%에서 90.30%로 증가함을 보였다. 이는 CaCO 3은 약 640℃ 이상의 고온에서 형태가 CaO로 변형(deformation)이 시작된다는 보고에 의해 본 XRD 분석결과에서도 열분해 전후 광물학적 변화가 없는 것으로 판단했으며[ 15], XRF 분석결과 300℃ 열분해 과정에서 산화물형태의 Ca 대비 S, Na, Cl의 손실로 CaO함량이 증가한 것으로 판단된다. SF와 NACSF의 비표면적과 공극부피도 열분해 이후 증가하는 것을 보였고, 표면특성을 SEM으로 관찰한 결과 열분해에 따라 상대적으로 표면의 공극이 증대됨을 확인할 수 있었다( Table 2, Fig. 4). 이는 열분해 과정에서 휘발성 물질과 물 분자의 방출로 인해 다공성(porosity)이 증가함에 따른 결과로 판단된다[ 16]. SF와 NACSF의 작용기 분석결과는 Fig. 3에 나타내었다. SF는 717 cm -1에서 calcite, 873 cm -1에서 carbonate 및 aromatic C-H, 1,081 cm -1에서 carboxlic acid C-O peak, 1,245 cm -1에서 vinyl ether C-O peak, 1,533 cm -1에서 nitro compound N-O peak, 1,650 cm -1에서 amide C=O, 1,805 cm -1에서 aryl carbonate, 2,854~2,956 cm -1에서 aliphatic C-H peak, 2,610~3,700 cm -1에서 hydroxyl group peak가 관측되었다[ 17, 18]. 이후 NACSF의 스펨트럼은 SF와 비슷한 경향을 보였으나 1,253 cm -1, 1,533 cm -1, 1,650 cm -1에서 peak가 관찰되지 않았고 2,854~2,956 cm -1, 2,610~3,700 cm -1에서는 상대적으로 완만해져 전체적으로 매끄러워진 것을 보였다. 이는 열분해 시 고온으로 인한 휘발성물질의 감소에 기인한다는 보고와 일치하였다[ 19]. 한편 Ahmad [ 13] 등과 Lim [ 16] 등은 열분해 시 873 cm -1에서 aromatic C-H가 peak가 증대되어 방향성이 증가한다고 보고하였으나 carbonate peak와 겹쳐(overlap) 정확한 확인이 어려운 것으로 판단된다[ 13, 14]. 한편 수득률은 85.23%로 나타났으며, 열분해에 따른 수산기(hydroxyl)의 탈수작용(dehydration)과 유기물분해에 의해 SF와 NACSF 수분함량은 2.00%에서 1.80%, 휘발분은 23.03%에서 9.43%로 감소하였다( Table 2) [ 20]. 회분함량은 40.37%에서 41.17%로 늘어났으며 이는 무기염류와 유기물질의 농축, 잔류물 생성에 의해 증가한 것으로 판단된다[ 13, 14]. 또한 pH는 열분해 시 유기물질 내 알칼리성 염의 분리로 인해 증가한다는 보고에 따라 7.41에서 10.04로 증가한 것으로 판단된다[ 13]. Ahmad [ 13] 등과 Lim [ 14] 등은 바이오차는 열분해 온도증가에 의해 탄화정도가 높아져 탄소함량이 증대되었다고 보고하였으나, 원소분석결과 SF, NACSF는 열분해에 따라 탄소함량이 각각 18.07%에서 15.12%로 감소하여 보고와 상반된 결과를 보였다( Table 2). 이는 NACSF는 유・무기 복합물질로 300℃에서 유기 탄소의 감소에 비해 CaCO 3의 무기 탄소는 CO 2형태로 전환되지 않음에 따른 결과로 판단되며, 산소함량의 증가에도 영향을 미친 것으로 사료된다. 반면 열분해에 따라 수소와 질소함량은 감소하였으며 수산기의 탈수작용과 질소함유 물질의 손실에 의한 결과라 판단된다[ 16].
3.2. 접촉시간에 따른 중금속 제거량 변화
접촉시간변화에 따른 폐수 내 중금속 제거율은 다음 Fig. 5와 같다. 각각의 중금속마다 흡착 후 평형농도에 도달하는 시간과 제거율은 Pb는 30분에서 98.8%, Cu는 240분에서 94,7%, Zn와 Cd는 모두 720분에서 각각 96.2%와 97.1%로 상이하여 중금속마다 다른 최적 접촉시간이 존재함을 보였다. 이에 대한 중금속의 흡착 속도를 판단하기 위해 유사일차반응식과, 유사이차반응식에 적용시켰으며 결과는 다음 Table 3과 같다. 표에서 흡착공정은 유사일차반응식에 비해 유사이차반응식이 상관계수가 모두 0.99 이상이 산출되어 유사이차속도모델이 더 적합한 것으로 나타났다. 유사이차속도모델의 K 2값은 무차원의 흡착속도상수로 중금속별 Pb≫Cu>Cd>Zn의 상수 값을 보임에 따라 Pb의 경우 흡착속도가 가장 빨랐고 Zn의 경우 가장 느림을 알 수 있었다. 이러한 흡착제에 대한 각각의 중금속 속도는 흡착제 표면에서 중금속 이온에 대한 친화도와 이온교환 능력이 다르기 때문이다[ 21]. 추가적으로 NACSF 투입 후 시간변화에 따른 pH 변화를 관찰하였다( Fig. 6). 투입 후 5분부터 폐수 내 pH는 처리 전 3에서 6.28~7.14로 상당한 증가를 보였다. 이는 폐수의 수소이온과 NACSF의 CaCO 3 성분의 반응으로 이산화탄소 농도가 증가한 후 수중에서 생성된 탄산 및 중탄산염이 처리폐수의 알칼리도를 상승시켜 수소이온에 대한 완충작용에 기인한 것으로 판단된다( 식 (13- 15)). 또한 Pb의 경우 pH가 NACSF 투입 후 빠른 증가추세를 보이다 40~60분에서, Cu의 경우 240분에서 둔화되었다. Zn와 Cd도 투입 5분 후 Pb와 Cu에 비해 높게 측정되었지만 이후 비교적 완만한 pH증가율을 보여, 모든 중금속들은 pH가 증가함에 따라 제거율도 비슷한 증가추세를 보이는 것을 알 수 있었다( Fig. 6). 중금속은 흡착과정 중 낮은 pH에서 중금속과 H +이온이 경쟁하면서 흡착을 이루지만 pH가 증가할수록 흡착제 표면에 많은 음전하가 하전됨에 따라 중금속 등 양이온의 흡착량이 증가한다[ 22]. 이에 중금속 폐수에 NACSF를 적용 시 시간에 따른 pH상승과 제거율의 상관관계에 따라, 접촉시간에 따른 pH상승이 흡착공정에 영향을 미치는 것으로 판단된다.
3.3. pH 변화에 따른 폐수 내 중금속 흡착량 변화
위의 결과와 같이 pH는 낮은 영역에서 중금속과 H +은 서로 경쟁관계 놓일 뿐만 아니라, 변화에 따라 중금속이온이 흡착되는 흡착점에 영향을 미쳐 흡착에 있어 매우 중요하다[ 23]. 따라서 동일한 중금속 농도에서 중금속 폐수의 pH를 1~5로 조절하여 pH 변화에 따른 NACSF의 중금속 제거율을 Fig. 7에 나타내었다. Pb의 경우, 나머지 중금속 대비 높은 흡착능을 보유한 것으로 보여 비교적 낮은 투입량으로 실험을 진행하였다. Fig. 7의 결과에 의하면, pH 1에서 Pb, Cu, Zn, Cd순으로 각각 11.8%, 35.4%, 46.6%, 19.7%로 가장 낮은 효율을 보였다. Cu의 경우 pH 4에서 97.2% Pb, Zn, Cd의 경우 pH 5에서 각각 99.1%, 96.6%, 97.5%의 최대 효율을 보였다. 이는 pH가 높아질수록 H +이온과 경쟁이 점차 줄어들어 중금속 흡착이 증대되는 위의 연구결과와 동일한 이유로 판단되었다. 또한 pH의 변화에 따라 용존 중금속의 이온종형태가 변하게 되는데 Pb, Cu, Zn,은 pH 6에서부터 Cd는 pH 8에서부터 MOH +와 M(OH) 2형태의 중금속의 가수분해 산물이 생성된다[ 24, 25]. 따라서 pH는 NACSF 표면의 –COOH와 –OH group의 관능기와 중금속 간의 흡착관계에 영향 미친 것으로 판단되며 Rahmane [ 23] 등, Jeon [ 26] 등, Zacaria [ 27] 등은 관능기에 대한 중금속 흡착은 다음 식 (16- 21)과 같은 반응을 따른다고 보고하였다. 한편 중금속 흡착 반응 후 pH 측정 결과를 Fig. 8에 나타내었다. Pb의 경우 상대적으로 낮은 투입량으로 실험한 영향에 따라 초기 pH 1에서는 강산성으로 인해 pH 상승이 더디었으나 pH 2~3에서 5.10~6.62로 급격한 상승, pH 4~5에서는 7.36~7.63으로 완만한 상승을 보였다. Cu, Zn, Cd의 경우 pH 1에서 4.33~4.98로, pH 2~3에서 6.13~7.17, pH 4~5에서는 7.43~7.84로 변화가 더디어 거의 평형을 이루는 것을 보였다. 이는 상당히 넓은 산성 pH 범위의 중금속 폐수에서 NACSF는 흡착과 중화작용이 동시에 작용함에 따라, 중금속 폐수로 대표적인 도금폐수, 산성광산배수(AMD)등의 중금속 흡착공정에서 높은 적용성을 보일 것으로 판단된다. 또한 산(acid)에 대한 NACSF의 완충능력(buffer capacity)에 따라 적절한 투입비가 고려되면 다양한 산성 물질로 인한 피해 복원과정에도 적용할 수 있을 것으로 판단된다.
3.4. 흡착제 투입량에 따른 폐수 내 중금속 제거량 및 pH변화
Pb, Cu, Zn, Cd를 모두 10 mg/L로 하고 pH 3.0으로 조절한 후 폐수 내 NACSF의 투입량을 0.5 g/L에서 20 g/L까지 조절한 것을 24시간 동안 교반하여 실험하였고, 각각의 중금속 제거율을 Fig. 9에 pH 변화를 Fig. 10에 나타내었다. 위 그래프의 결과에 따르면 NACSF의 투입량이 증가함에 따라 Pb의 경우 53.8~99.3%, Cu는 14.6~92.5%, Zn는 7.4~98.5%, Cd는 7.5~98.5%까지 제거율이 증가함을 보였다. 또한 Pb, Cu, Zn, Cd 순으로 투입량이 1.5 g/L, 4.0 g/L, 나머지 원소는 10 g/L부터 투입량을 증가시켜도 더 이상 제거효율이 증가되지 않음을 보였다. 이는 Pb가 가장 적은 투입량으로도 흡착이 용이한 것을 알 수 있으며 타 연구결과의 경향과 일치하였다[ 28- 30]. 또한 NACSF 투입량 변화에 따라 pH는 초기 0.5 g에서 5.79~6.56로 크게 증가되었고 10 g/L에서 7.6~7.9까지 증가되었으나 증가량은 점차 완만해져 20 g/L에서는 7.78~8.14로 투입량 대비 거의 변화하지 않았다. 이는 CaCO 3의 중성상태에서 매우 낮은 용해도와 pH 8.3 이상에서는 더 이상 반응하지 않은 특성에 기인한 것으로 판단되며[ 31], 고농도 폐수에 적용 시 높은 투입량에서도 처리 후 일정한 pH를 유지할 수 있을 것으로 판단된다. 한편 Cu의 경우 상대적으로 낮은 투입량에서 높은 처리효율을 보였으나 이후 투입량에 비례해 처리효율이 증가하지 않고 최대 92.5%까지만 도달하였다. 이때 잔류 Cu농도는 약 0.75 mg/L로 다른 중금속과(0.05~0.15 mg/L) 비교해 높은 농도를 보임에 따라(Data not shown) Cu와 NACSF의 성분에 의한 흡착관계의 추가적인 연구가 필요할 것으로 보인다.
3.5. 흡착등온모델에 대한 해석
중금속 용액 내 흡착제를 접촉 시 흡착제 표면에서 중금속 농도는 평형에 이를 때까지 증가하고 평형에 도달하면 중금속이온은 흡착제 표면과 액상으로 분리된다. 등온흡착모델은 평형에 도달할 때 중금속이온이 어떠한 형태로 표면과 액상으로 분리되는지 나타내는 모델로 대표적으로 Fuendlich과 Langmuir 모델이 사용되고 있다. Fruendlich 모델은 비균질한 흡착제 표면에 피흡착질이 다층(multilayer)으로 분포할 때 적합한 식으로 알려져 있다[ 32]. 이때 K와 1/n값은 각각 흡착능과 흡착강도를 나타내는 상수로서 K값이 커짐에 따라 흡착능이 증가하고 1/n값이 낮을수록 흡착 결합은 크며 0.1~0.5 사이에 존재할 때 피흡착질은 흡착이 용이하다. 또한 weber [ 33] 등은 1/n값이 1보다 클 경우 S형, 1일 경우 C형 등온 흡착, 1보다 작을 경우 L형 흡착성을 갖는다고 하였다. 하지만 Freundlich 모델의 경우 무기오염물질에 비해 유기오염물질의 흡착에 더 잘 어울리며[ 34], Fig. 11과 Table 4에 나타낸 결과와 같이 상관계수 값과 추세곡선은 Langmuir 모델과 비교할 시 상대적으로 실험결과 값과 일치하지 않았다. Langmuir 모델은 동적인 평형상태에서 빈 흡착점과 피흡착질의 충돌에 의해 이루어지며 흡착제 표면에 단분자층(monolayer)으로 흡착한다고 가정하며 에너지 분포가 균일한 흡착제에 적합한 것으로 알려져 있다[ 35]. Langmuir 모델에서 a (mg/g)값은 피흡착질이 표면에 흡착할 수 있는 최대흡착량으로 a값이 클수록 친화도가 크며 b값은 온도에 따른 흡착 엔탈피를 나타내고 분리계수(R L)를 구하기 위한 상수이다. 분리계수(K L)가 1보다 크면 흡착공정에 적합하지 않고(unfavorable), 1이면 선형(linear), 0일 때와 0<K L<1일 때 각각 비가역(irreversible), 적합(favorable)하다[ 36]. 폐수 내 중금속 성분에 따른 NACSF의 흡착량를 Langmuir 모델에 적용한 결과 Pb, Cu, Zn, Cd 순으로 r 2값은 0.99, 0.95, 0.98, 0.99이었고, 최대흡착량(mg/g)은 11.14, 2.77, 1.65, 1.59, 분리계수(R L)는 모두 0에서 1사이로 나타났다( Table 5). 따라서 수용액 상에서 Pb, Cu, Zn, Cd와 NACSF의 관계는 Fig. 11에 나타낸 것과 같이, C e와 q의 관계에서 평형농도가 증가하여도 흡착량이 더 이상 증가하지 않은 것을 미루어 보았을 때, 본 흡착공정은 단층의 흡착과정으로 인해 흡착점이 포화상태 이후에는 흡착량이 일정한 결과를 보인 것으로 판단되며, 이에 따라 상관계수 값이 Freundlich 모델에 비하여 Langmuir 모델에 부합한 것으로 보인다. 이 결과는 바이오차의 중금속 흡착의 경우 주로 이온 교환을 통한 단분자층의 흡착이 이루어져 Langmuir 모델에 적합하다는 보고와 일치하였고[ 36], 식 (18-23)에 나타낸 Carboxyl group, OH group등의 작용기에 의한 이온교환 가능성을 뒷받침하였다. 또한 Zachara [ 37] 등은 Calcite와 limestone은 CaCO 3성분이 주를 이루어 중금속 수용액 내에서 다음 식 (22)와 같이 표면에서의 이온교환이 이루어진다고 보고하였다. 더불어 Papadopoulos [ 38] 등은 수용액상에서 평형을 도달할 때까지 Ca와 Cd와 Zn간의 교환을 통해 CdCO 3와 ZnCO 3를 생성한다고 보고하였고 이를 탄산염에 기인한 침전작용이라고 표현하였으며, Sanchez [ 39] 등은 calcite의 표면에서 Cd는 CdCO 3, Zn은 Zn 5(OH) 6(CO 3) 2형태의 hydrozincite로 침전한다고 보고하여 NACSF는 중금속과 다양한 반응이 이루어질 것으로 예상되었다. 이밖에도 중금속 흡착에서 가수분해상수(hydrolysis constant), 원자량(Atomic weight), 이온반경(ionic radius), 전기음성도(electronegativity), 연성(softness) 등의 다양한 인자가 존재해 흡착공정에 영향을 미치는 것으로 알려져 있다[ 40]. 이 중 가수분해상수가 가장 큰 영향을 미치며 이는 중금속의 가수분해 시 생성되는 MOH +는 열역학적으로 더 안정적이고 자유 금속이온(free metal cation)보다 흡착에 용이하기 때문이다[ 41, 42]. 본 연구에서는 Pb와 Cu의 경우 Zn과 Cd에 비해 가수분해가 용이한 것에 따라[ 41], 최대흡착량이 Pb≫Cu>Zn≥Cd 순으로 나타난 것으로 판단된다. 본 연구결과를 바탕으로 타 연구결과와 비교한 표를 Table 6에 나타내었다. 이에 바이오차는 바이오매스 종류, 열분해 온도, 흡착되는 중금속에 따라 흡착량이 달라지는 것을 알 수 있으며, 향후 SF는 다양한 조건에서 바이오차 연구가 필요할 것으로 사료된다. 또한 중금속이 NACSF의 표면에서 흡착됨을 관찰하기 위해 NACSF를 중금속 수용액에 적용 후 여과・건조한 잔여물(residue)을 SEM-EDX로 표면 원소분포를 관찰하였다( Fig. 12). Pb의 경우 일정 표면에서 Pb peak가 나타나 NACSF표면에서 Pb가 흡착됨을 직접적으로 확인하였으나 나머지 중금속은 상대적으로 낮은 흡착량으로 인해 관찰되지 않은 것으로 판단된다. 이에 따라 중금속 수용액 내에서 NACSF는 유・무기물의 공존에 의한 흡착과 침전 등 복합적인 흡착메커니즘을 따르는 것으로 보이며, Sposito [ 47] 등은 이를 수착(sorption)이라 표현하였다.
4. 결 론
불가사리를 7℃/min 승온조건으로 300℃에서 제조한 NACSF를 각각 Pb, Cu, Zn, Cd로 오염된 폐수에 적용하여 이용가능성을 판단하고자 하였다. 기기분석을 통한 특성평가 결과 열분해 전(SF)에는 비교적 탄소 함량이 적으며 칼슘 등의 무기물이 다량 공존해 이전에 보고된 바이오매스와 다른 특성을 보였다. 열분해 후(NACSF)에는 탄소함량이 저하되었으나 이는 CaCO3에 의한 영향으로 판단되며 휘발성물질의 손실로 표면이 개질되고 비표면적이 늘어나는 것을 알 수 있었다. 또한 NACSF에서 흡착에 영향을 미치는 관능기가 발견되었다. 중금속별 농도가 10 mg/L일 때 최대흡착량은 Pb≫Cu>Zn≥Cd의 결과를 보여 NACSF는 Pb의 흡착에 가장 용이한 것으로 판단되었고, 흡착 결과를 흡착등온식에 적용한 결과 Pb, Cu, Zn, Cd 모두 Fruendlich 모델보다 Langmuir 모델에 부합하였다. 한편 모든 실험군의 pH를 측정한 결과 NACSF는 CaCO3의 성질에 의해 넓은 산성조건에서 처리공정 중 알칼리도를 상승시켜 처리 후 용액은 약알칼리성을 띠었고, 이에 의해 일부 금속수화물에 의한 침전가능성 및 중화능력을 보였다. 따라서 NACSF는 흡착 및 침전에 의한 복합적인 메커니즘을 따르는 것으로 판단되며, 산성 중금속(Pb, Cu, Zn, Cd) 폐수에서 높은 이용성을 보일 것으로 판단된다.
Acknowledgments
본 연구는 한국연구재단(NRF)의 기초연구사업(과제번호: 2019R1F1A1053374)의 지원으로 수행한 연구이며, 이에 감사드립니다.
Fig. 1.
Asterina pectinifera and pulverized and sieved (-#10 mesh materials) starfish (SF). 
Fig. 2.
Pyrolysis device and processed biochar (NACSF). 
Fig. 3.
XRD patterns and FT-IR peak for SF and NACSF. 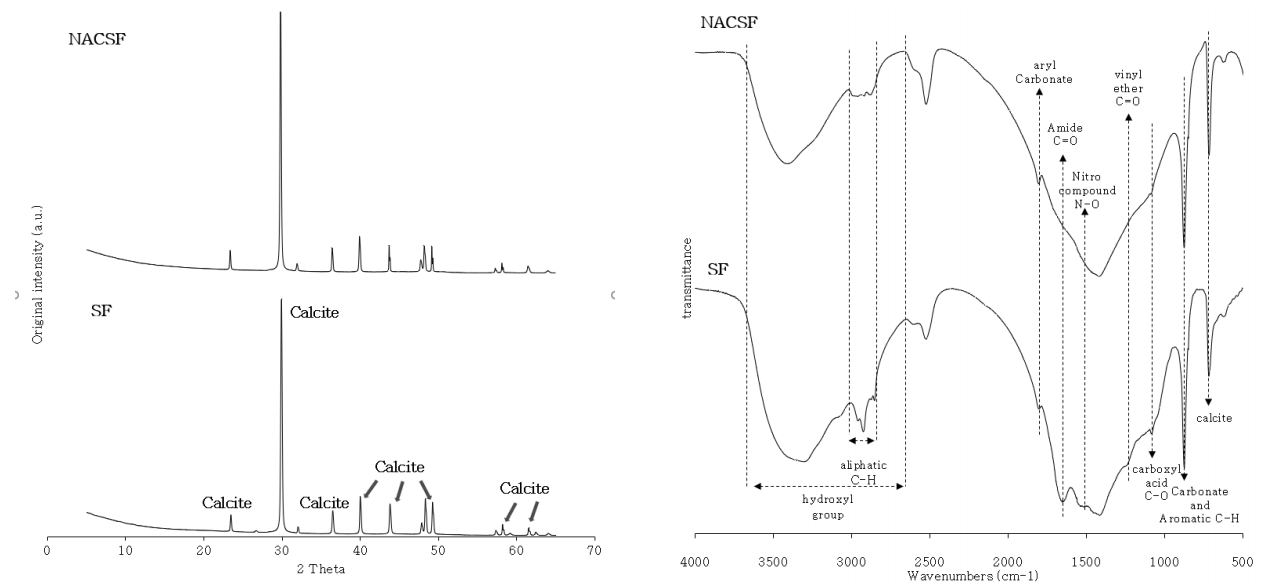
Fig. 4.
SEM-EDX images of the surface of SF and NACSF. 
Fig. 5.
Effect of contact time on heavy metal removal rate by NACSF at 5 g/L, 10 mg/L heavy metal concentration, pH 3 and room conditions at 20~23℃. 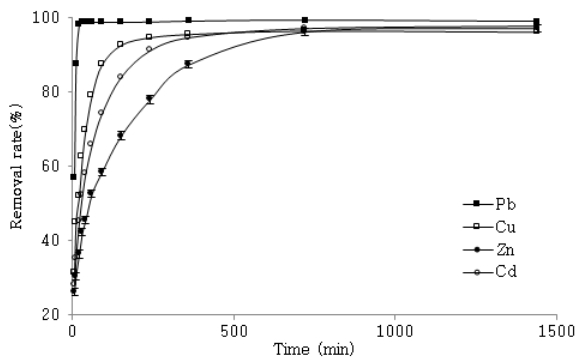
Fig. 6.
Effect of contact time on pH variation by NACSF at 5 g/L, 10 mg/L heavy metal concentration, pH 3 and room conditions at 20~23℃. 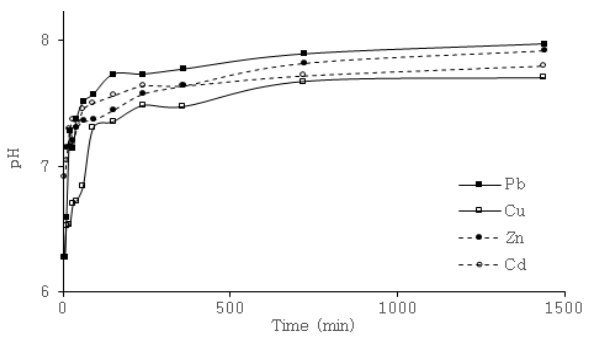
Fig. 7.
Effect of pH on the heavy metal removal rate by NACSF at 10 mg/L heavy metal concentration, dosage of NACSF (1 g/L for Pb and 5 g/L for Cu, Zn, Cd) and 20℃. 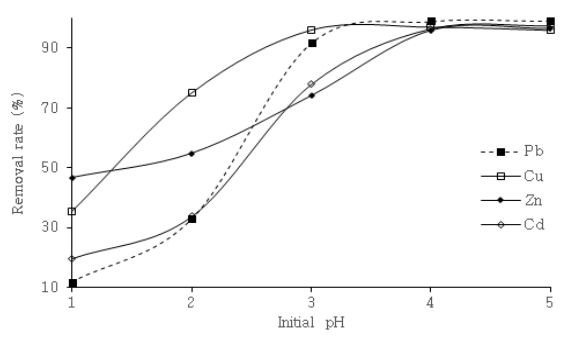
Fig. 8.
Effect of initial pH on treatment pH by NACSF at 10 mg/L heavy metal concentration, dosage of NACSF (1 g/L for Pb and 5 g/L for Cu, Zn, Cd) and 20℃. 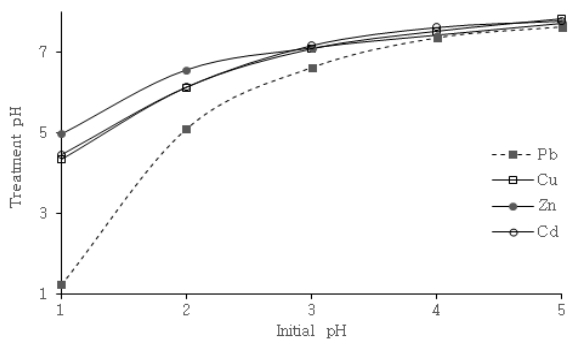
Fig. 9.
Effect of dosage on heavy metal removal rate by NACSF at 10 mg/L heavy metal concentration, 20℃, 24 h and pH 3. 
Fig. 10.
Effect of pH on heavy metal removal by NACSF at 10 mg/L heavy metal concentration, dosage of NACSF (1 g/L for Pb and 5 g/L for Cu, Zn, Cd) and 20℃. 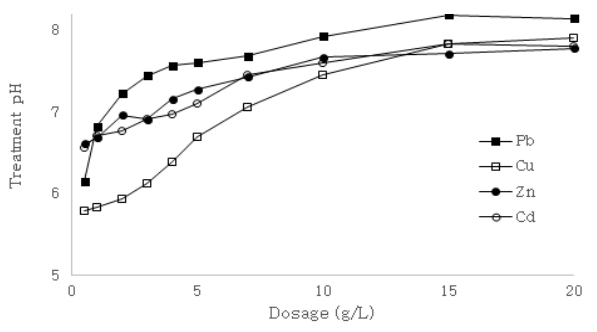
Fig. 11.
Experimental data and calculated value from the Freundlich and Langmuir adsorption isotherm for heavy metals. 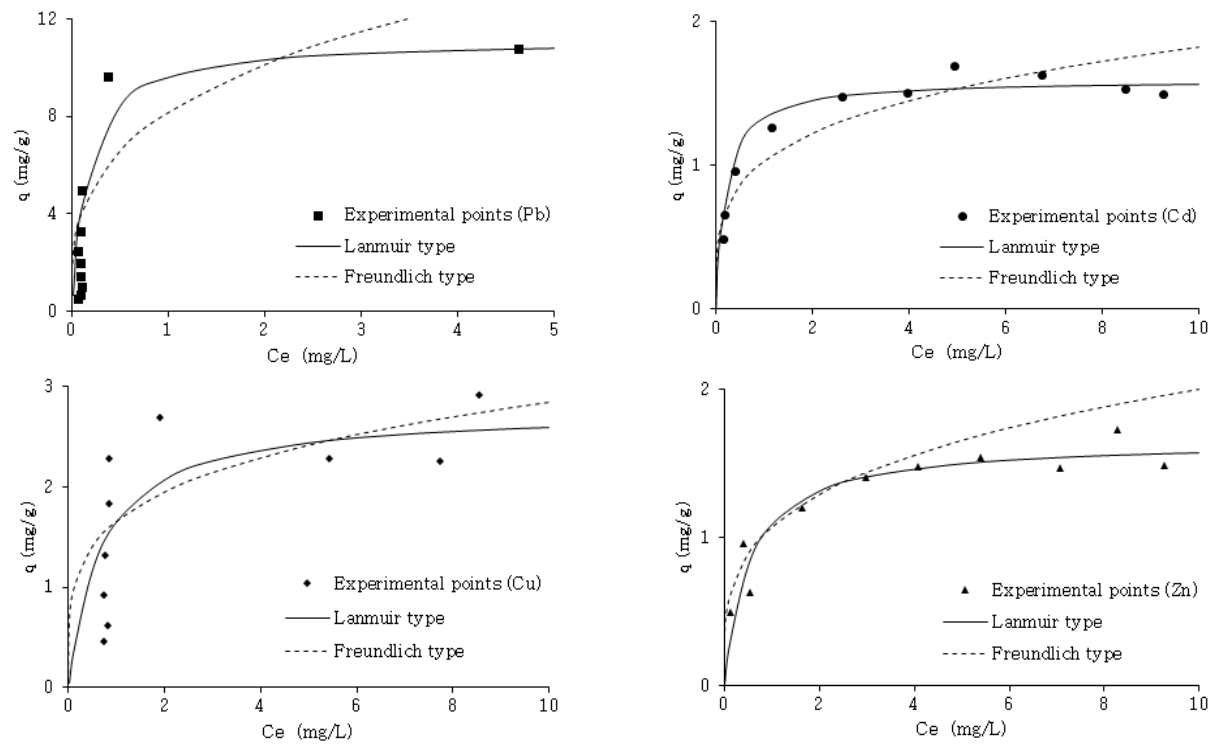
Fig. 12.
A SEM image of NACSF residue and EDX spectrum after treatment for the Pb solution. 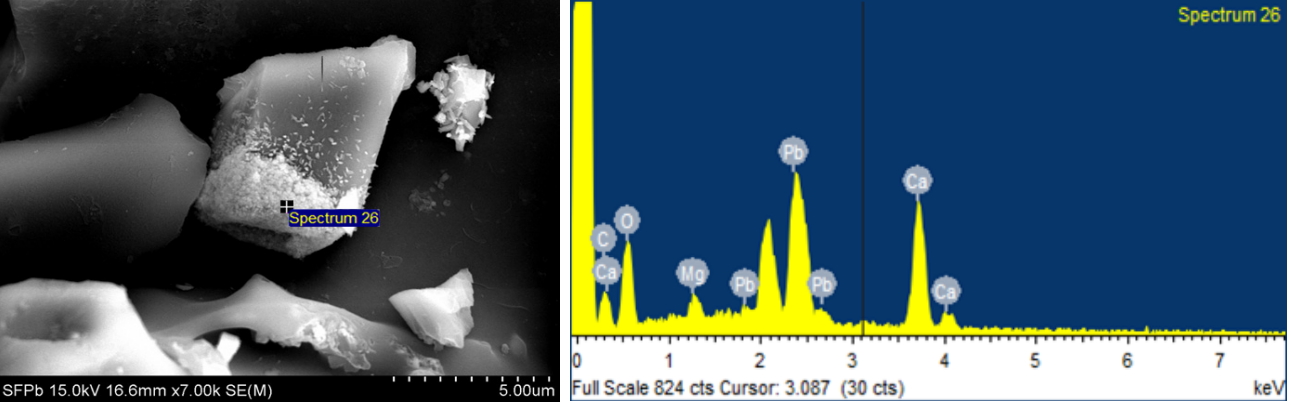
Table 1.
Chemical composition of the SF and NACSF from XRF.
|
Compound |
Proportion (%)
|
|
SF |
NACSF |
|
CaO |
86.00 |
90.30 |
|
MgO |
7.24 |
7.78 |
|
SO3
|
2.68 |
0.15 |
|
Na2O |
1.37 |
0.12 |
|
Cl |
0.84 |
0.03 |
|
P2O5
|
0.58 |
0.52 |
|
SrO |
0.43 |
0.38 |
|
SiO2
|
0.31 |
0.12 |
|
K2O |
0.17 |
0.16 |
|
Al2O3
|
0.14 |
0.03 |
|
WO3
|
0.03 |
0.18 |
|
MnO |
0.02 |
0.03 |
Table 2.
Physiochemical properties of SF and NACSF.
|
Parameters |
Unit |
SF |
NACSF |
|
Yield |
wt (%) |
- |
85.23 |
|
Moisture |
" |
2.00 |
0.43 |
|
Mobile matter |
" |
23.03 |
8.97 |
|
Ash |
" |
40.37 |
26.30 |
|
Resident matter |
" |
34.60 |
64.30 |
|
pH (1:10) |
- |
7.41 |
10.04 |
|
C |
wt (%) |
18.07 |
15.12 |
|
H |
" |
1.76 |
0.89 |
|
O |
" |
77.94 |
82.89 |
|
N |
" |
2.23 |
1.10 |
|
S |
" |
- |
- |
|
H/C |
" |
0.10 |
0.06 |
|
O/C |
" |
4.31 |
5.48 |
|
Surface area |
m2/g |
0.33 |
0.67 |
|
Pore volume |
cm3/g |
0.002 |
0.006 |
Table 3.
The pseudo-first-order kinetic and pseudo-second-order kinetic model parameters by heavy metals on NACSF.
|
Pseudo-first-order kinetic model
|
Pseudo-second-order kinetic model
|
|
K1
|
r2
|
K2
|
r2
|
|
Pb |
0.1014 |
0.7979 |
0.1725 |
0.9948 |
|
Cu |
0.0111 |
0.9046 |
0.0338 |
0.9994 |
|
Zn |
0.0025 |
0.8687 |
0.0110 |
0.9982 |
|
Cd |
0.0029 |
0.7840 |
0.0208 |
0.9998 |
Table 4.
The Freundlich adsorption isotherm parameters and equation for heavy metals.
|
Fruendlich
|
|
K |
1/n |
Equation |
r2
|
|
Pb |
8.1452 |
0.3124 |
y = 0.3124x + 0.9109 |
0.7215 |
|
Cu |
1.6520 |
0.2355 |
y = 0.2355x + 0.2180 |
0.4884 |
|
Zn |
0.9401 |
0.2739 |
y = 0.2739x - 0.0268 |
0.8761 |
|
Cd |
1.0313 |
0.2483 |
y = 0.2483x + 0.0134 |
0.8759 |
Table 5.
The Langmuir adsorption isotherm parameters and equation for heavy metals.
|
Langmuir
|
|
a (qm, mg/g) |
b (L/mg) |
RL
|
Equation |
r2
|
|
Pb |
11.14 |
0.0013 |
0.9872 |
y = 0.0898x + 0.0144 |
0.9987 |
|
Cu |
2.77 |
0.0880 |
0.5319 |
y = 0.3616x + 0.2434 |
0.9521 |
|
Zn |
1.65 |
5.2834 |
0.0186 |
y = 0.6045x + 0.3131 |
0.9864 |
|
Cd |
1.59 |
12.7256 |
0.0078 |
y = 0.6278x + 0.1252 |
0.9949 |
Table 6.
The maximum heavy metal adsorption capacities for different biochars as reported in the literatures.
|
Adsorbent |
Heavy metal |
Pyrolysis temperature (℃) |
a (qm, mg/g) |
Source |
|
Orange waste |
Cu |
300 |
4.921 |
Pellera [9] |
|
Dried olive pornace |
Cu |
300 |
5.118 |
Pellera [9] |
|
Hickory chips |
Pb |
600 |
11.2 |
Ding [43] |
|
Oak bark |
Pb |
mixed with 400 and 450 |
13.10 |
Mohan [44] |
|
Cd |
5.40 |
|
Pine bark |
Pb |
mixed with 400 and 450 |
3.00 |
Mohan [44] |
|
Cd |
0.34 |
|
Rice husk |
Pb |
300 |
2.40 |
Liu [45] |
|
Corn straw |
Cu |
450 |
6.79 |
Chen [46] |
|
Zn |
4.54 |
|
Hardwood |
Cu |
600 |
12.52 |
Chen [46] |
|
Zn |
11.00 |
|
NACSF |
Pb |
300 |
11.14 |
This work |
|
Cu |
2.77 |
|
Zn |
1.65 |
|
Cd |
1.59 |
References
1. C. E. Lee, Veterinary Toxicology, Seoul National University(1993).
2. D. H. Kim, S. B. Kim, Removal characteristics of heavy metals in acid wastewater by ceramics using natural zeolite and converter slag, J. Korean Soc. Environ. Eng., 34(4), 239-246(2012).  3. R. Say, A. Denizli, M. Y. Arica, Biosorption of cadmium(II), lead(II), and copper(II) with the filamentous fungus phanerochaete chrysosporium, Bioresour. Technol., 76(1), 67-70(2001).  4. I. W. Choi, D. C. Seo, S. W. Kang, S. G. Lee, Y. J. Seo, B. J. Lim, J. S. Heo, J. S. Cho, Adsorption characteristics of heavy metals using sesame waste biochar, Korean J. Soil. Sci. Fert., 46(1), 8-15(2013).  5. J. Lehmann, S. Joseph, Biochar for Environmental Management Science, Technology and Implementation, 2nd ed.., Earthscan, London, UK(2015).
6. J. H. Park, S. H. Kim, J. H. Shin, H. C. Kim, D. C. Seo, Competitive adsorption characteristics of cupper and cadmium using biochar, Korean J. Environ. Agric., 34(1), 21-29(2015).  7. F. M. Pellera, A. Giannis, D. Kalderis, K. Anastasiadou, R. Stegmann, J. Y. Wang, E. Gidarakos, Adsorption of Cu(II) ions from aqueous solutions on biochars prepared from agricultural by-products, J. Environ. Manage., 96(1), 35-42(2012).  8. W. H. Im, Y. H. Lim, Y. S. Kim, P. J. Park, H. J. Kim, Study of fermentation condition of anti-oxidant and anti-inflammatory effects of starfish extract fermented by cordyceps militaris, J. Korea Immuno-Yakchim Soc., 4(2), 27-36(2015).
9. K. H. Kim, I. Y. Lee, B. J. Choi, S. M. Lee, S. H. Kim, Treatment of acid mine drainage wter using wsted sudge of seafood processing factory and starfish, J. Korean Soc. Environ. Eng., 24(3), 489-497(2002).
10. D. H. Moon, I. S. Hwang, A. Koutsospyros, K. H. Cheong, Y. S. Ok, W. H. Ji, J. H. Park, Stabilization of lead (Pb) and zinc (Zn) in contaminated rice paddy soil using starfish: a preliminary study, Chemosphere., 199, 459-467(2018).  11. K. S. Hong, H. M. Lee, J. S. Bae, M. G. Ha, J. S. Jin, T. E. Hong, J. P. Kim, E. D. Jeong, Removal of heavy metal ions by using calcium carbonate extracted from starfish treated by protease and amylase, J. Anal. Sci. Technol., 2(2), 75-82(2011).  12. P. G. Hwang, I. S. Shin, M. C. Eu, C. H. Choi, S. M. Lee, Characteristics of heavy metal removal using iron-coated starfish, KSWST Jour. Wat. Treat., 12(4), 19-26(2004).
13. M. Ahmad, S. S. Lee, X. Dou, D. Mohan, J. K. Sung, J. E. Yang, Y. S. Ok, Effects of pyrolysis temperature on soybean stover-and peanut shell-derived biochar properties and TCE adsorption in water, Bioresour. Technol., 118, 536-544(2012).  14. J. E. Lim, S. S. Lee, Y. S. Ok, Efficiency of poultry manure biochar for stabilization of metals in contaminated soil, J. Appl. Biol. Chem., 58(1), 39-50(2015).  15. H. J. Park, S. W. Jeong, J. K. Yang, B. G. Kim, S. M. Lee, Removal of heavy metals using waste eggshell, J. Environ. Sci., 19(12), 1436-1441(2007).  16. K. Y. Chan, Z. Xu, Biochar: nutrient properties and their enhancement, Biochar for Environmental Management Science and Technology. J. Lehmann, S. Joseph(Eds.), Earthsans, London, UK, pp. 67-84(2009).
17. J. Coates, Interpretation of infrared spectra, a practical approach, Encyclopedia of Analytical Chemistry: Applications, Theory and Instrumentation. R. A. Meyers(Ed.), John Wiley & Sons, New Jersey, USA, pp. 10815-10837(2011).
18. M. K. Mun, Y. J. Jang, J. E. Kim, G. Y. Yeom, D. W. Kim, Plasma functional polymerization of dopamine using atmospheric pressure plasma and a dopamine solution mist, RSC Adv., 9(23), 12814-12822(2019).  19. J. E. Lim, H. W. Kim, S. H. Jeong, S. S. Lee, J. E. Yang, K. H. Kim, Y. S. Ok, Characterization of burcucumber biochar and its potential as an adsorbent for veterinary antibiotics in water, J. Appl. Biol. Chem., 57(1), 65-72(2014).  20. J. M. Novak, I. Lima, B. Xing, J. W. Gaskin, C. Steiner, K. C. Das, M. Ahmedna, D. Rehrah, D. W. Watts, W. J. Busscher, H. Schomberg, Characterization of designer biochar produced at different temperatures and their effects on a loamy sand, Ann. Environ. Sci., 3, 195-206(2009).
21. M. Q. Jiang, X. Y. Jin, X. Q. Lu, Z. L. Chen, Adsorption of Pb(II), Cd(II), Ni(II) and Cu(II) onto natural kaolinite clay, Desalination., 252(1-3), 33-39(2010).  22. Z. Reddad, C. Gerente, Y. Andres, P. L. Cloirec, Adsorption of several metal ions onto a low-cost biosorbent, Environ. Sci. Technol., 36(9), 2067-2073(2002).  23. M. S. Rahman, M. R. Islam, Effect of pH on isothems modeling for Cu(II) ions adsorption using maple wood sawdust, Chem. Eng. J., 149(1-3), 273-280(2009).  24. M. E. Argun, S. Dursun, C. Ozdemir, M. Karatas, Heavy metal adsorption by modified oak sawdust: thermodynamics and kinetics, J. Hazard. Mater., 141(1), 77-85(2007).  25. J .Y. Choi, J. Y. Lee, J. S. Yang, Biosorption of heavy metals and uranium by starfish and pseudomonas putida, J. Hazard. Mater., 161(1), 157-162(2009).  26. C. Jeon, J. Y. Park, Y. J. Yoo, Biosorption model for binary adsorption sites, J. Microbiol. Biotechnol., 11(5), 781-787(2001).
27. R. Zacaria, G. Claire, A. Yves, L. C. Pierre, Modeling of single and competitive metal adsorption onto a natural polysaccharide, Environ. Sci. Technol., 36(10), 2242-2248(2002).  28. S. K. Papageorgiou, F. K. Katsaros, E. P. Kouvelos, J. W. Nolan, H. L. Deit, N. K. Kanellopoulos, Heavy metal sorption by calcium alginate beads from laminaria digitata, J. Hazard. Mater., 137(3), 1765-1772(2006).  29. J. Liang, B. R. Lim, S. K. Lee, Biosorption characteristics of heavy metals using enteromorpha prolifera, J. Korea Soc. Waste. Manag., 33(1), 85-91(2016).  30. D. Y. Jeon, K. S. Lee, H. M. Shin, K. J. Oh, Adsorption characteristics of heavy metals for waste sludge and oyster shell, J. Environ. Sci. Int., 15(11), 1053-1059(2006).  31. W. A. Wurts, R. M. Durborow, Interactions of pH, carbon dioxide, alkalinity and hardness in fish ponds, SRAC Publication No. 464(1992).
32. H. M. F. Freundlich, Over the adsorption in solution, J. Phys. Chem., 57, 385-470(1906).
33. J. B. Weber, C. T. Miller, Organic chemical movement over and through soil, Reactions and Movement of Organic Chemicals in Soils. 22, B. L. Sawhney, K. Brown(Eds.), Soil Science Society of America, Inc., Agronomy Society of America, Inc., Madison Wisconsin, USA, pp. 305-334(1989).
34. H. J. Choi, Removal of Pb(II) form aqueous solution using hybrid adsorbnet of sericite and spent coffeee grounds, Appl. Chem. Eng., 29(5), 571-580(2018).
35. I. Langmuir, The adsorption of gases on plane surface of glass, J. Am. Chem. Soc., 40(9), 1361-1403(1918).  36. K. R. Hall, L. C. Eagleton, A. Acrivos, T. Vermeulen, Pore- and solid-diffusion kinetics in fixed-bed adsorption under constant-pattern conditions, Ind. Eng. Chem. Fundamen., 5(2), 212-223(1966).  37. J. M. Zachara, C. E. Cowan, C. T. Resch, Sorption of divalent metals on calcite, 55(6), 1549-1562(1991).  38. P. Papadopoulos, D. L. Rowell, The reactions of copper and zinc with calcium carbonate surfaces, Eur. J. Soil Sci., 40(1), 39-48(1989).  39. A. G. Sanchez, E. A. Ayuso, Sorption of Zn, Cd and Cr on calcite: application to purification of industrial wastewater, Miner. Eng., 15(7), 539-547(2002).  40. A. R. A. Usman, The relative adsorption selectivities of Pb, Cu, Zn, Cd and Ni by soils developed on shale in New Valley, Egypt, Geoderma., 144(1-2), 334-343(2008).  41. R. O. James, T. W. Healy, Adsorption of hydrolyzable metal ions at the oxide-water interface. III. A thermodynamic model of adsorption, J. Colloid Interface Sci., 40(1), 65-81(1972).  42. C. F. Baes, R. E. Mesmer, The Hydrolysis of Cations, John Wiley and SonNew York, USA(1976).
43. Z. Ding, X. Hu, Y. Wan, S. Wang, B. Gao, Removal of lead, copper, cadmium, zinc, and nickel from aqueous solutions by alkali-modified biochar: batch and column tests, J. Ind. Eng. Chem., 33, 239-245(2016).  44. D. Mohan, C. U. Pittman Jr., M. Bricka, F. Smith, B. Yancey, J. Mohammad, P. H. Steele, M. F. Alexandre-France, V. Gómez-Serrano, H. Gong, Sorption of arsenic, cadmium, and lead by chars produced from fast pyrolysis of wood and bark during bio-oil production, J. Colloid Interface Sci., 310(1), 57-73(2007).  45. Z. Liu, F.-S. Zhang, Removal of lead from water using biochars prepared from hydrothermal liquefaction of biomass, J. Hazard. Mater., 167(1-3), 933-939(2009).  46. X. Chen, G. Chen, L. Chen, Y. Chen, J. Lehmann, M. B. McBride, A. G. Hay, Adsorption of copper and zinc by biochars produced from pyrolysis of hardwood and corn straw in aqueous solution, Bioresour. Technol., 102(19), 8877-8844(2011).  47. G. Sposito, The Surface Chemistry of Soils, Oxford University PressNew York, USA(1984).
|
|






















