The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
열수액화공정에서 레드머드 촉매를 이용한 리그닌 분해
Abstract
Lignin is produced as a by-product in kraft and bioethanol production processes as well as in the pulp and paper industry. Convensionally, most of it is burned for heat energy recovery, and only about 2% of it is utilized as a useful chemical synthesis. Recently, research has been actively conducted worldwide to replace various phenolic compounds produced in the existing petrochemical industry with lignin degradation products that are environment friendly. Under the subcritical condition (35 0℃, 2 hr, H2: 1 MPa), lignin was decomposed and converted to bio-oil in the presence of red-mud (RM) and activated red-mud (ARM) catalysts. In particular, when red mud was used as a catalyst, the HHV was increased by 11.45 MJ/kg compare to the Kraft lignin, while carbon (C) and hydrogen (H) contents were increased by 17.99% and 1.87% respectively. Moreover, the yield of bio oil was increased by 8% (with RM catalyst) and 1.8% (with ARM catalyst) compare to the control experiment. GC-MS results showed that the produced bio-oil was comprised of cetechol and guaiacol type monomers as the major compounds. The overall results suggested that the red mud catalyst increased the bio oil yield, high heating value (HHV), and catechol production during the lignin decomposition technique.
Key words: Lignin, Hydrothermal Liquefaction, Subcritical Water, Aromatic Compound, Redmud
요약
리그닌은 크래프트 및 바이오 에탄올 생산공정뿐만 아니라 펄프 및 제지 산업에서 부산물로 발생된다. 일반적으로 대부분 열에너지 회수를 위하여 연소 처리되고 이중 약 2%만 유용화학물질 합성재료 및 연료전환 등으로 활용되고 있다. 최근 기존 석유화학 산업에서 생산되던 다양한 페놀화합물을 친환경 소재인 리그닌 분해산물로 대체하려는 연구가 세계적으로 활발히 진행되고 있다. 리그닌을 아임계수 조건(350℃, 2 hr, 수소가스 1 MPa)에서 레드머드(Red-mud, RM) 및 활성레드머드 (Activated red-mud, ARM) 촉매로 분해하여 바이오오일로 전환하였다. 특히, 레드머드를 촉매로 사용한 경우 고위발열량은 kraft리그닌에 비해 11.45 MJ/Kg 증가되었고 탄소와 수소의 함량은 각각 17.99%와 1.87% 증가되었다. 또한 바이오오일의 수율은 촉매가 없는 경우에 비해 각각 8% (with RM catalyst)와 1.8% (with ARM catalyst) 증가되었다. GC-MS결과 생성된 바이오오일의 주요 화합물은 Cetechol과 Guaiacol 및 두 화합물의 monomer 형태였다. 따라서, 리그닌 분해 시 레드머드 촉매는 발열량(HHV), 바이오오일 수율, Cetechol생산을 높이는 것으로 나타났다.
주제어: 리그닌, 열수액화, 아임계수, 방향족화합물, 레드머드
1. 소 개
석유 자원은 각종 연료와 석유 화학 제품의 생산원료로 사용되어 왔다. 하지만 석유자원은 매장량이 한정되어 있으며 황, 질소, 중금속 등과 같은 대기 오염 유발 물질을 다량 포함하고 있어, 이를 대체할 에너지 자원의 연구개발이 시급한 실정이다[ 1]. 최근 이러한 석유자원을 대체할 신 에너지원으로 많은 연구가 진행되고 있으며 그 중 리그닌은 식물계 바이오매스 성분으로 주목할 가치가 있다. 리그닌은 자연에 존재하는 풍부한 방향족 고분자물질(aromatic biopolymer)이며, 목재를 구성하는 주요 물질 중 하나로 수종에 따라 약 15-30% 함량을 갖는다[ 2]. 리그닌은 1819년 스위스 식물학자 A. P. Candolle (1778-1841)에 의해 Lignin이라는 단어를 도입하였으며 “나무”를 의미하는 라틴어 lignum에서 유래되었다. 리그닌은 지구상에서 두 번째로 풍부한 비정질 고분자 물질이며 이 물질은 크게 3가지 p-coumaryl alcohol, coniferyl alcohol, sinapyl alcohol로 나뉘며 C-O-C (β-O-4, α-O-4, 4-O-5)와 C-C (β-5, 5-5) 결합으로 연결되어 있다( Fig. 1) [ 3]. 리그닌은 phenyl propane units로 이루어진 amorphous aromatic polymer로 열분해 되었을 때 guaiacol, vanillin, syringol, anisole 등의 물질이 생산된다. 리그닌은 기존의 석유화학 산업에서만 생산되던 다양한 페놀화합물을 친환경 소재인 리그닌을 통해 대체하려는 연구가 전세계적으로 활발히 진행되고 있다[ 3~ 5]. 그러나 아직 국내에서는 리그닌 활용에 관한 연구는 미비한 편이며 특히 효율적인 리그닌 분해를 통한 페놀 화합물의 생산에 관한 연구는 부진한 실정이다. 이러한 리그닌 분해산물은 바이오오일, 재(Char), 합성가스(Syngas) 등으로 전환되며, 이때 생성물 수율 및 화학적 특성은 반응온도, 반응시간, 수소분압, 촉매유무 용매종류 등에 따라 변한다고 알려져 있다[ 6~ 12]. 알루미늄 제련 과정에서 매년 27만 톤이 발생하는 레드머드는 토목․건설자재, 토양개량제 등 다양한 분야에 연구가 진행되고 있으며, 또한 레드머드를 촉매로 이용하는 연구도 활발히 진행중에 있다[ 13]. 최근 연구에 따르면 레드머드의 주요 성분인 Al 2O 3와 SiO 2는 리그닌 분해에 활용할 수 있는 촉매의 성분인 것으로 보고되었다[ 14, 16, 17, 19]. 이러한 화합물들은 단일촉매 또는 Zeolite (ZSM-5, SiO 2/Al 2O 3)와 결합한 형태로 사용되고, 산촉매의 촉매지지체(Support catalysts) 역할로 사용되기도 한다. 촉매로 사용될 경우 벤조퓨란, 에탄올, 메탄올 등과 같은 유기용매들과 함께 사용되어 리그닌 분해산물인 바이오오일의 수율을 높이는 것으로 알려져 있다[ 14~ 19]. 열수액화공정에 사용되는 물은 아임계(T < 374℃, P < 221 bar) 상태에서 유전상수, 극성, 점성, 표면장력 등이 급격히 감소한다. 온도가 상승할수록 물분자 간의 수소 결합력이 약해져 유전상수(dielectric constant, ε) 및 극성(polarity)이 감소되며 비극성 유기용매들의 유전상수와 유사하게 된다[ 20]. 이에 따라 아임계수를 통한 바이오매스 전환 프로세스는 반응공정에 유기용매를 사용하지 않으므로 친환경적이며, 일반적으로 사용되는 고온열분해에 비해 낮은 온도에서 바이오매스를 효율적으로 분해할 수 있는 공정인 것으로 판단된다. 따라서, 본 연구에서는 바이오에탄올 생산 공정 및 펄프공정에서 발생하는 부산물인 크래프트 리그닌을 열수액화 공정 아임계수 조건 하에서 Red-mud (RM) 및 Activated redmud (ARM) 촉매를 적용하여 바이오오일을 생성하고, 생성된 바이오오일의 특성을 분석하였다.
2.재료 및 방법
2.1. 열수액화공정(Hydrothermal Liquefaction Process)
열수액화 반응기는 하스텔로이드 재질로 디지털 압력, 온도, 시간제어 시스템 및 압력 게이지, 가열, 회전속도 설정 등이 가능하며 또한 내부의 반응 압력을 나타내는 압력 게이지도 설치되어있다. 반응기의 최대 온도 및 압력 용량은 450 ℃, 500 kgf/cm2이다.
2.2. 레드머드(Red-mud)
전라남도 대불산업단지 내에 위치한 OO 주식회사의 알루미나 제련과정에서 발생한 부산물(Red-mud)을 별도의 가공 없이 사용하였다. 레드머드는 산화철을 다량 함유하고 있어 색은 적갈색을 띄며 알루미나 제련과정에서 NaOH 첨가로 인해 pH 11 이상의 강한 알칼리성을 띄고 있으며 리그닌 분해에 촉매 담지체로 사용되는 Al2O3, SiO2 등을 함유하고 있다.
2.3. 활성레드머드(Activated Red-mud)
활성레드머드(ARM)는 레드머드 20 g을 100 mL의 증류수와 1 : 5비율로 혼합하여 10분간 교반한 뒤 6 M HCl 100 mL를 가하여 90℃에서 2시간 동안 수욕조안에서 교반 소화시켰다. 그 다음 암모니아수(NH3-H2O)로 pH가 8이 될 때까지 적가한 뒤 다량의 따뜻한 증류수를 통해 pH 7에 가깝게 수차례 세척하였다. 그 뒤 드라이 오븐을 사용하여 110℃에서 12시간 동안 1차 건조한 후 전기로를 사용하여 600℃에서 2시간 동안 소성하여 사용하였다.
2.4. 리그닌 분해 및 분해산물 분리공정
열수액화 반응기에 크래프트리그닌 5 g, 증류수 150 mL, 촉매 2 g을 넣고 고순도 질소가스(99.9%)를 10분간 흘려 활성가스를 제거하였다. 활성가스 제거 후 고순도 수소가스를 투입하여 1 MPa에서 밀봉하고 반응온도 350℃까지 승온 후 2시간 동안 200 RPM으로 교반하며 반응을 진행하였다. 반응 후 생성물(고체, 액체)은 모두 수집하여 혼합물의 올리고머 및 잔류물의 침전을 위해 HCl을 첨가하여 산성화(pH 2.0)시켰다. 산성화된 생성물은 에틸아세테이트와 혼합하여 여과하였으며 여액은 회전 증발기 70℃에서 농축하고 이후 건조오븐 60℃에서 6시간 건조한 분해산물을 바이오오일로 하였다. 여과지 잔류물은 다시 에틸아세테이트를 사용하여 깨끗한 여액이 나올 때까지 세척하고 세척된 여과액은 회전 증발기를 사용하여 동일한 방법으로 바이오오일을 얻었으며 이 두 바이오오일을 합한 것을 바이오오일의 수율로 하였다( Fig. 2). Char 생성량은 상기 과정에서 여과되지 않은 고체생성물을 건조하여 발생량을 산출하였다. 실험은 3회 반복으로 진행하였으며, 실험값의 평균값 및 표준편차를 이용하여 그래프로 나타내었고, 값의 유의성 분석은 IBM SPSS Statistics 23 프로그램을 이용한 ANOVA검정으로 실시하였다.
2.5. GC-MS 분석
가스크로마토그래피-질량분석기(GC-MS)는 Agilent 6890(Agilent Technologies, USA)의 Scan 모드를 이용하여 분석하였다. GC의 컬럼은 30 m × 0.25 mm × 0.25 μm의 규격을 사용하였다. 컬럼온도는 40℃에서 2분간 유지한 후 170℃까지 10℃/min으로 승온시킨 뒤 5분간 유지하였다. 그 뒤 10℃/min의 속도로 컬럼을 250℃로 승온 후 10분간 유지, 이후 310℃까지 승온 후 10분간 유지하였다. 측정시료는 오토 샘플러를 사용하여 샘플을 유출 모드에서 1.5 cm/min의 속도로 주입하였다. electron impact ionization mode는 질량 검출기를 작동하기 위해 사용되었고, 질량 스펙트럼을 NIST 라이브러리와 비교하여 화합물의 성분을 도출하였다.
3. 결과 및 토의
3.1. 촉매의 화학적조성
RM의 화학적 조성은 Fe2O 3의 함량이 가장 높았으며 Al 2O 3와 SiO 2가 주된 조성이었으며 ARM의 화학적 조성 또한 Fe2O 3, Al 2O 3, SiO 2가 주된 조성으로 나타났다( Table 1). 이는 Gladstone, Australia지역에서 생산되는 레드머드와 유사한 것으로 조사되었다[ 21, 22]. 보통 레드머드의 주성분은 산화철(Fe2O 3), 산화알루미늄(Al 2O 3), SiO 2, TiO 2, Na 2O, CaO, MgO 이고 K, Cr, V, Ni, Cu, Mn, Zn과 같은 많은 부성분을 가지고 있다. 일반적으로 산화철로 인해 붉은색을 띄며, 레드머드의 주요 구성성분은 광석의 생성과정, 품질 및 공정과정에 따라 함량이 변화한다[ 23~ 28]. 리그닌 분해에 있어 Al 2O 3, SiO 2는 높은 수율을 내는 촉매로 알려져있다. Al 2O 3, SiO 2는 단일 촉매로도 좋은 수율을 내며 금속촉매와 결합하여 Ni/Al 2O 3, Ni/SiO 2 등의 형태로 촉매지지체의 역할을 수행하기도 한다. 최근 연구에 따르면 Zeolite (ZSM-5, SiO 2/Al 2O 3)의 형태 또한 좋은 수율을 내는 것으로 조사되었다[ 17~ 22]. Na 2O와 CaO의 경우 RM에서 10.69%와 5.45%였으며, 활성화시킨 ARM에서 두 화합물은 0.13%와 1.17%로 감소되었다. Na와 Ca 함량의 변화는 나트륨 화합물은 탈수 및 세척시스템에 따라 달라질 수 있으며 시간이 지남에 따라 잔류하는 나트륨 성분은 탄산나트륨 및 기타금속 탄산염 종의 형성을 위해 대기 중 이산화탄소에 의해 부분적으로 중화될 수 있으며 산처리로 인해 감소될 수 있다[ 29~ 30]. ARM의 Na 2O와 CaO의 감소는 레드머드의 활성 과정 중 산처리 및 증류수 세척 과정 등의 요인들로 인해 감소되었을 것으로 판단된다.
3.2. 촉매의 표면특성 분석
BET분석 결과 RM 표면적은 37.104 m 2/g이었으며 ARM는 255.47 m 2/g, 공극부피의 값은 RM가 0.1877 cm 3/g ARM가 0.4773 cm 3/g였다. 주된 공극의 직경은 RM 28.07 nm, ARM 5.57 nm이었으며, 평균 공극의 직경은 RM 20.232 nm ARM 7.4732 nm로 ARM에서 더 작은 공극직경, 높은 표면적을 보이는 것으로 분석되었다( Table 2). 레드머드의 입자크기는 매우 미세하며 표면적이 큰 것이 특징이다. 표면적은 일반적으로 20 m 2/g ~ 64 m 2/g의 표면적을 가지며 염산을 이용한 활성 방법을 사용한 연구들에서의 표면적 분포는 60 m 2/g ~ 184.1 m 2/g인 것으로 조사되었다[ 31~ 35]. 이러한 레드머드의 표면적은 Na와 Ca 함량에 따라 달라 질 수 있다. Na는 다중 고리 방향족 화합물의 수소화를 위한 촉매로써의 역할이 가능하다[ 22]. 그러나 Na와 Ca 성분함량이 많을수록 Al 2O 3와의 소결이 촉진되어 입자 크기가 증가하고 표면적이 감소하여 촉매의 활성이 저해되는 것으로 보고되었다[ 31, 36]. 본 연구에서 상기 활성레드머드 표면적이 레드머드 보다 크게 증가된 이유는 활성과정 및 증류수 세척 등으로 촉매 표면에서 Na와 Ca 성분이 제거 되고 함량이 감소하여 표면적 증가에 기여한 것으로 판단된다.
3.3. 촉매의 SEM-EDX 분석
RM는 큰 입자와 작은 입자가 서로 뒤 섞여 있는 모양이었으며 ARM는 상대적으로 작은 입자들이 뭉쳐있는 형태였다( Fig. 3). 상업적으로 판매되고 있는 일반적인 촉매의 경우 나노미터 크기를 갖는 균일한 결정에 의해 형성되어 있는 반면, 레드머드는 상이한 크기의 입자 및 다른 형태의 결정으로 구성되며 그로 인해 형태와 내부 구조가 매우 다양하며 불균일한 것이 특징이다[ 37]. RM는 알루미나 제련 후에도 7.95 wt% 알루미늄이 잔류되어 있었으며 알루미늄 제련과정에서 사용된 NaOH로 인해 Na 또한 5.71 wt% 잔류되어 있었다( Table 3). 반면, ARM의 경우 Na와 Ca성분은 나타나지 않았다. 추출 공정에서 사용되는 가성소다에 포함된 나트륨 성분은 탈수 및 세척 시스템에 따라 함량이 변할 수 있다[ 29~ 30]. ARM에 Na와 Ca 성분이 나타나지 않은 것은 레드머드 활성과정에 포함되어 있는 산처리 및 증류수 세척과정에서 촉매 표면의 Na와 Ca이 제거되어 나타나지 않은 것으로 판단된다.
3.4. 바이오오일 구성 원소분석
Lignin Powder의 원소분석결과 탄소, 수소, 산소는 53.68%, 4.95%, 38.80%였으며, HHV는 19.05 MJ/kg이었다( Table 4). 촉매 사용이 없는(Control) 아임계 상태의 물을 용매로 사용한 바이오오일의 탄소는 15.39%, 수소는 1.45% 증가하였으며 산소는 14.7% 감소하며 HHV값은 9.49 MJ/kg 증가하였다. 아임계 상태의 물과 RM 촉매 조건에서 바이오오일은 가장 높은 탄소(71.67%)와 수소(6.82%) 함량 및 고위발열량(HHV)값을 보였고 Lignin powder에 비해 탄소는 17.99%, 수소는 1.87%, HHV는 11.45 MJ/kg 증가한 것으로 나타났다. 황(S)은 RM 촉매 조건에서 생성된 바이오오일 내 비율이 Lignin powder 대비 1.79% 감소하였다. 일반적으로 황은 촉매독(Catalytic poison)으로써 촉매의 활성을 낮춘다고 알려져 있다. 그러나 레드머드와 특정 금속 산화물은 황과 같은 촉매독에 민감하지 않으며 쉽게 촉매 활성을 잃지 않는 것으로 밝혀졌다[ 22, 36]. 수소는 리그닌 분해 반응 중 라디칼을 포함한 불안정한 리그닌 분해산물과 결합하여 안정화된 구조로 변환되므로 재축합 반응을 억제하는 역할을 한다[ 38]. 결과적으로 RM촉매가 사용된 바이오오일에서 증가된 수소와 감소된 산소는 수소첨가반응 및 탈산소반응이 있었을 것으로 생각되며 이로 인해 높은 HHV 값을 얻을 수 있었을 것으로 판단된다. HHV의 계산은 Dulong’s Formula에 따라 계산되었다[ 39].
3.5. 바이오오일의 수율
리그닌 분해산물인 바이오오일, Char, Gas 수율은 다음과 같다( Fig. 4). 레드머드(RM) 촉매조건에서 바이오오일 수율 및 Gas는 촉매 미첨가조건보다 각각 8, 3.1 wt% 높게 나타났다. 활성 레드머드(ARM) 촉매조건에서 수율, Gas는 촉매 미첨가조건보다 1.8, 0.1 wt% 차이를 보였으나 레드머드 촉매 조건에 비해 큰 차이를 보이지 않았다. Char는 촉매 미첨가 조건에 비해 촉매 RM과 ARM을 사용하였을 경우 각각 11.1 wt%, 1.9wt% 감소한 것으로 나타났다. 리그닌 분해 산물인 Char의 경우 반응 중 사용된 촉매 표면에 흡착되어 촉매의 활성이 떨어지도록 유도하는 물질로 바이오오일 분해공정에서 적게 생산될수록 유리하다고 알려져 있다[ 40]. 리그닌 분해산물인 Char는 NaOH를 염기촉매로 사용하였을 경우 리그닌 분해 과정에서 Char의 생성을 억제시켜 분해 효과 및 바이오오일의 수율을 향상시킨 것으로 보고되었다[ 41~ 42]. 본 연구에서 ARM촉매 조건에서보다 RM조건에서 Char 생성이 더 억제되었고, 바이오오일 생성은 더 증가하였다. 이는 RM에 함유된 Na 2O는 반응기 내에서 H 2O와 반응하여 NaOH로 변환되었을 것으로 생각되며, 이렇게 변환된 NaOH는 리그닌 분해 과정에서 Char의 생성을 억제시켜 분해 효과 및 바이오오일의 수율을 향상시켰을 것으로 판단된다.
3.6. 바이오오일 내 화합물 분석(GC-MS)
생성된 바이오오일 내의 화합물은 총 20종으로 대부분 방향족 화합물이었다( Table 5). RM촉매 사용시 촉매무첨가(Control)에 비해 1,2-Benzenediol (Catechol)은 19.08% 증가하였으며 3-methyl-catechol과 4-methylcatechol은 각각 1.76, 9.23% 증가하였다. Catechol화합물 형태의 단량체의 비율이 증가함에 따라 2-methoxy-phenol (Guaiacol) 형태의 단량체의 비율이 감소하였다. 이는 리그닌의 분해과정 중 생성된 Guaiacol의 수소화 분해 또는 탈메틸화를 통해 Catechol이 생성되기 때문이다. 이러한 Catechol은 수소화 탈산소화를 통해 H2O과 함께 Phenol이 생성될 수 있다.
RM을 촉매로 사용한 바이오오일의 페놀화합물 중 Phenol과 Catechol, Resorcinol 화합물의 수율은 Control 보다 높게 나타났다. 그 외의 페놀화합물은 RM촉매 사용시 Control 보다 감소되었고, 특히 Guaiacol과 4-methylphenol이 18.73%와 7.65%씩 감소되었다. Chaudhary 등[ 43]은 리그닌 분해공정에서 생성되는 페놀화합물들이 CaO에 흡착되어 촉매를 사용하지 않았을 때보다 수율이 전체적으로 감소된다는 결과를 발표하였다. 이를 상기 실험결과와 비교하면 Phenol과 Catechol, Resorcinol은 오히려 증가되었고, 그 외 페놀화합물은 모두 감소되었다. 이것은 리그닌 분해 변수인 반응온도, 반응시간, 수소분압, 용매종류 등에 복합적인 요인과 비교적 소량인(5.45 wt%) CaO보다 Al 2O 3와 SiO 2 같은 성분의 높은 함량 등이 페놀화합물 생성에 영향을 끼친 것으로 판단되며 이에 대한 추후 연구가 요구된다.
4. 결 론
본 연구는 열수액화공정에서 레드머드 촉매에 따른 리그닌 분해 효율을 분석하였으며, 리그닌 분해 시 HHV, 수율, Cetechol 화합물의 비율이 향상된 것으로 조사되었다.
1) 레드머드의 표면적은 37.104 m2/g이었으며, 이를 산처리 활성 방법을 통해 255.47 m2/g까지 증가시킬 수 있었다. 또한 공극부피의 값은 0.29 cm3/g 증가하였고 공극직경은 12.76 nm 감소하였다.
2) 활성 레드머드의 Na, Ca 함량의 감소 이유는 활성과정 및 증류수 세척 등으로 인해 표면에서 Na와 Ca 성분이 제거됨에 따라 함량이 감소한 것으로 판단된다.
3) 레드머드에 함유된 Na2O는 반응기 내의 H2O와 반응하여 NaOH로 변환되어 리그닌 분해 과정에서 Char의 생성을 억제하며 바이오오일의 수율을 향상시킨 것으로 판단된다.
4) 바이오오일은 반응 전 리그닌보다 고위발열량(HHV)이 증가되었으며, 성분구성비에서 탄소와 수소성분이 증가되고 산소비율이 감소되었다. 특히, 레드머드를 촉매로 사용한 경우 고위발열량은 11.45 MJ/kg 증가되고 탄소와 수소는 각각 17.99 %와 1.87 %씩 증가되었다.
5) 바이오오일의 수율은 레드머드를 촉매로 사용하였을 경우 Control 바이오오일의 수율보다 8 wt% 증가하였으며 또한 Char 생산량은 11.1 wt% 줄일 수 있었다.
6) GC-MS 분석결과 바이오오일 내 화합물은 총 20종으로 분석되었으며, 대부분 방향족 화합물이었다. 레드머드 촉매 사용시 촉매무첨가(Control)에 비해 Catechol monomer의 함량이 증가하였으며, 대표적으로 Catechol은 19.08% 증가하였다.
Acknowledgments
이 연구는 한국연구재단(과학기술정보통신부) 중견연구지원사업의 지원으로 수행되었습니다(과제번호: NRF-2016R1A2B4008115). 이에 감사드립니다.
Fig. 1.
The monolignols composing the structure of lignin. 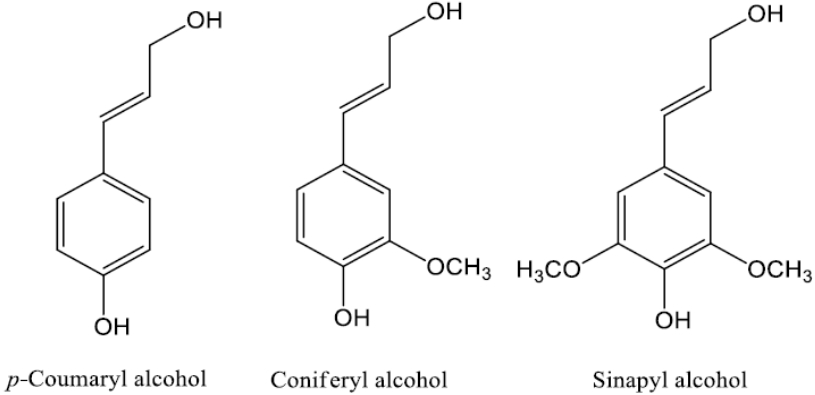
Fig. 2.
Product separation procedure. 
Fig. 3.
SEM analysis results for RM, ARM. 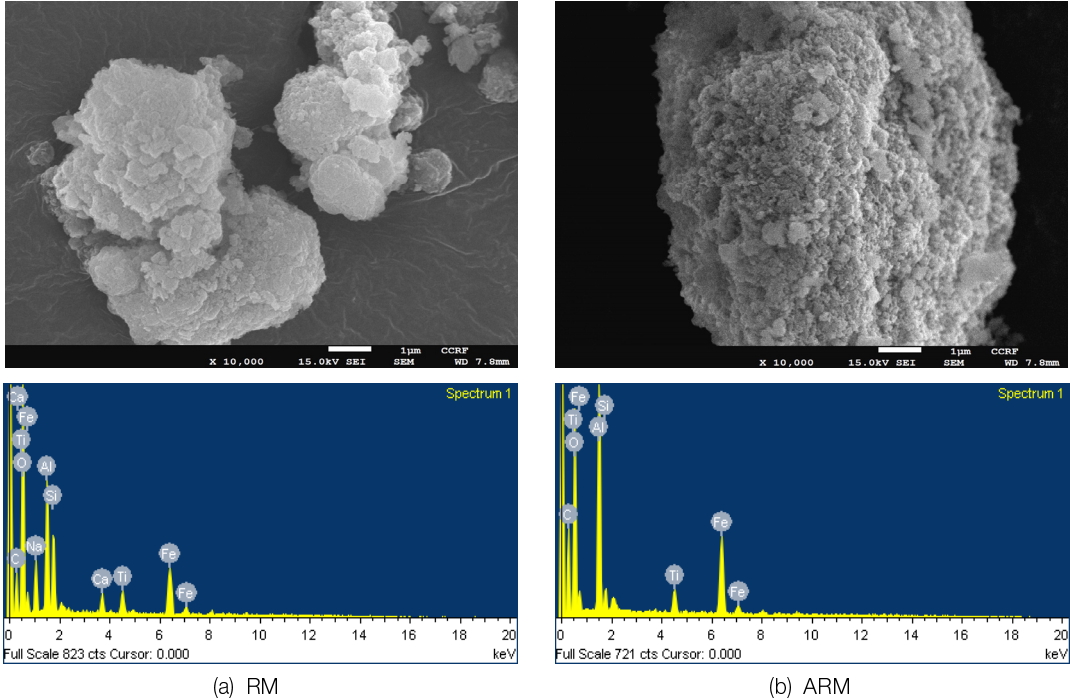
Fig. 4.
Overall yields of lignin degradation products (The asterisks that share the same letters are not significantly different at α = 0.05, 95% confidence level according to duncan's test). 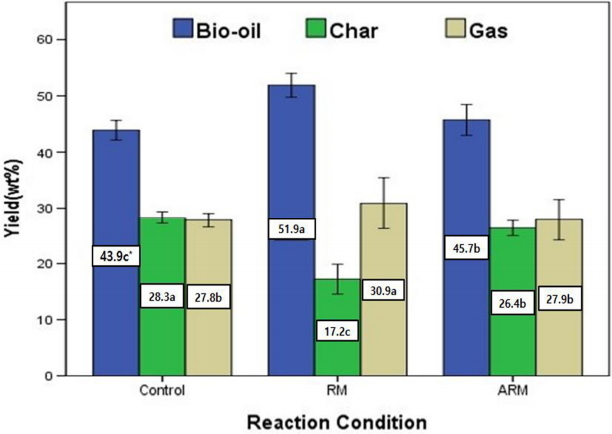
Table 1.
XRF results of RM and ARM
|
Catalyst |
Fe2O3 (%) |
Al2O3 (%) |
SiO2 (%) |
Na2O(%) |
TiO2 (%) |
CaO (%) |
|
RM |
34.87 |
22.11 |
17.14 |
10.69 |
7.8 |
5.45 |
|
ARM |
45.87 |
24.67 |
17.76 |
0.13 |
8.62 |
1.17 |
Table 2.
BET analysis results for RM, ARM
|
Catalyst |
Surface area [m2 g-1] |
Total pore volume [cm3 g-1] |
Mean pore diameter [nm] |
Meso pore diameter [nm] |
|
RM |
37.104 |
0.1877 |
20232 |
28.07 |
|
ARM |
25547 |
04773 |
74732 |
5.57 |
Table 3.
EDX analysis results for RM, ARM
|
Element |
Weight (%) |
Atomic (%) |
|
C |
16.52 |
24.79 |
|
O |
51.01 |
57.48 |
|
Na |
5.71 |
4.48 |
|
Al |
7.95 |
5.31 |
|
Si |
4.82 |
3.1 |
|
Ca |
1.54 |
0.69 |
|
Ti |
2.36 |
0.89 |
|
Fe |
10.09 |
3.26 |
|
Element |
Weight (%) |
Atomic (%) |
|
C |
27.71 |
39.68 |
|
O |
44.06 |
47.36 |
|
Al |
11.44 |
7.29 |
|
Si |
1.31 |
0.8 |
|
Ti |
2.12 |
0.76 |
|
Fe |
13.35 |
4.11 |
Table 4.
Elemental composition (C, H, O, N, S) and HHV of bio-oil
|
Catalyst |
C (%) |
H (%) |
O (%) |
N (%) |
S (%) |
O/C |
H/C |
HHV (MJ/kg) |
|
Lignin |
Powder |
53.68 |
4.95 |
38.80 |
0.52 |
2.05 |
0.72 |
0.092 |
19.05 |
|
Control |
Bio-Oil |
69.07 |
6.40 |
24.01 |
0.18 |
0.34 |
0.35 |
0.093 |
28.54 |
|
RM |
71.67 |
6.82 |
21.10 |
0.17 |
0.26 |
0.29 |
0.095 |
30.50 |
|
ARM |
69.56 |
6.61 |
23.42 |
0.12 |
0.29 |
0.34 |
0.095 |
29.10 |
Table 5.
Grouped products yield found from kraft lignin liquefaction (by relative % peak area)
|
RT |
Compound |
Control |
RM |
ARM |
|
9.976 |
Phenol |
2.42 |
2.50 |
1.85 |
|
12.811 |
Phenol,4-methyl- |
- |
1.10 |
- |
|
13.224 |
Phenol, 2-methoxy- |
24.75 |
6.02 |
14.75 |
|
15.873 |
2-Methoxy-3-methylphenol |
- |
- |
0.93 |
|
16.286 |
2-Methoxy-4-methylphenol |
9.26 |
1.61 |
6.13 |
|
16.444 |
1,2-Benzenediol |
25.13 |
44.21 |
32.93 |
|
18.184 |
1,2-Benzenediol, 3-methyl- |
3.59 |
5.35 |
4.24 |
|
18.713 |
Phenol,4-ethyl-2-methoxy- |
7.05 |
1.15 |
7.56 |
|
18.978 |
1,2-Benzenediol, 4-methyl- |
10.82 |
20.05 |
13.51 |
|
20.363 |
4-Fluorocumene |
- |
0.45 |
- |
|
20.654 |
2,5-Dimethylhydroquinone |
- |
2.01 |
1.22 |
|
21.083 |
Phenol,2-methoxy-4-propyl- |
1.64 |
- |
2.60 |
|
21.458 |
1,3-Benzenediol ,4-ethyl- |
6.07 |
8.54 |
4.64 |
|
22.066 |
1,3-Benzenediol,4,5-dimethyl- |
- |
1.14 |
- |
|
23.769 |
Acetaldehyde, (phenylthio)- |
- |
- |
1.50 |
|
23.775 |
(S)-(+)-5-sec-Butyl-2-pyrimidinol |
2.97 |
1.00 |
- |
|
25.166 |
(-)-R-Phenethanamine, 1-methyl-N-vanillyl- |
- |
- |
1.19 |
|
27.842 |
Benzeneacetic acid, 4-hydroxy-3-methoxy- |
- |
- |
0.77 |
|
37.695 |
7,12-dimethyl-3,4-epoxy-1,2,3,4-tetrahydrobenz[a]anthracene |
- |
- |
1.00 |
|
40.657 |
1,2-Dimethyl[2.2]paracyclophan-1-ene |
- |
1.00 |
1.18 |
|
|
Total |
|
93.70 |
96.12 |
96.00 |
References
1. H. J.. Eom, Y. K.. Hong, S. H.. Chung, M. Y.. Park, K. Y.. Lee, Depolymerization of Kraft lignin at Water-Phenol Mixture Solvent in Near Critical Region, J. Energy Eng., 20(1), 36-43(2011).  2. J. Y.. Kim, E. J.. Shin, I. Y.. Eom, Structural features of lignin macromolecules extracted with ionic liquid from poplar wood, Bioresour. Technol., 102(19), 9020-9025(2011).  3. C.. Xu, R. A. D.. Arancon, J.. Labidi, R.. Luque, Lignin depolymerisation strategies: towards valuable chemicals and fuels, Chem. Soc. Rev., 43(22), 7485-7500(2014).  4. C.. Amen-Chen, H.. Pakdel, C.. Roy, Production of monomeric phenols by thermochemical conversion of biomass: a review, Bioresour. Technol., 79(3), 277-299(2001).  5. H.. Li, X.. Yuan, G.. Zeng, J.. Tong, Liquefaction of rice straw in sub-and supercritical 1, 4-dioxane-water mixture, Fuel Proc. Technol., 90(5), 657-663(2009).  6. S.. Karagoz, T.. Bhaskar, A.. Muto, Y.. Sakata, M. A.. Uddin, Low-Temperature Hydrothermal Treatment of Biomass: Effect of Reaction Parameters on Products and BoilingPoint Distributions, Energy & Fuels., 18(1), 234-241(2004).  7. S.. Karagöz, T.. Bhaskar, A.. Muto, Y.. Sakata, Hydrothermal upgrading of biomass: Effect of K2CO 3 concentration and biomass/water ratio on products distribution, Bioresour. Technol., 97(1), 90-98(2006).  8. M.. Deniel, G.. Haarlemmer, A.. Roubaud, E.. Weiss-Hortala, J.. Fages, Optimisation of biooil production by hydrothermal liquefaction of agro-industrial residues: Blackcurrant pomace (Ribes nigrum L.) as an example, Biomass and Bioener., 95, 273-285(2016).  9. M.. Jindal, M.. Jha, Effect of process parameters on hydrothermal liquefaction of waste furniture sawdust for bio-oil production, RSC Adv., 6(48), 41772-41780(2016).  10. S.. Nizamuddin, H. A.. Baloch, G. J.. Griffin, N. M.. Mubarak, R.. Abro, S. A.. Mazari, B. S.. Ali, An overview of effect of process parameters on hydrothermal carbonization of biomass, Renewable and Sust. Energy Rev., 73, 1289-1299(2017).  11. T. D. H.. Nguyen, M.. Maschietti, L. E.. Amand, L.. Vamling, L.. Olausson, S. I.. Andersson, H.. Theliander, The effect of temperature on the catalytic conversion of Kraft lignin using nearcritical water, Bioresour. Technol., 170, 196-203(2014).  12. Y.. Ye, J.. Fan, J.. Chang, Effect of reaction conditions on hydrothermal degradation of cornstalk lignin, J. Analytical and Appl. Pyrolysis., 94, 190-195(2012).  13. J.. Kim, S. J.. Park, D.. Shin, D. H.. Moon, Y. G.. Kim, B. C.. Ryu, J. H.. Park, Effect of Ameliorant with Bauxite byproduct on the Germination and Growth of Lettuce by Acidic Soil Neutralization, J. Korean Soc. Environ. Eng., 40(6), 258-266(2018).  14. J. Y.. Kim, S.. Heo, J. W.. Choi, Effects of phenolic hydroxyl functionality on lignin pyrolysis over zeolite catalyst, J. Fuel., 232, 81-89(2018).  15. R.. Olcese, M. M.. Bettahar, B.. Malaman, J.. Ghanbaja, L.. Tibavizco, L.. Petitjean, A.. Dufour, Gas-phase hydrodeoxygenation of guaiacol over iron-based catalysts. Effect of gases composition, iron load and supports (silica and activated carbon), Appl. Catal. B: Environ., 129, 528-538(2013).  16. R. N.. Olcese, M.. Bettahar, D.. Petitjean, B.. Malaman, F.. Giovanella, A.. Dufour, Gas-phase hydrodeoxygenation of guaiacol over Fe/SiO 2 catalyst, Appl. Catal. B: Environ., 115/116, 63-73(2012).  17. Y.. Wang, T.. He, K.. Liu, J.. Wu, Y.. Fang, From biomass to advanced bio-fuel by catalytic pyrolysis/hydroprocessing: Hydrodeoxygenation of bio-oil derived from biomass catalytic pyrolysis, Bioresour. Technol., 108, 280-284(2012).  18. A. L.. Jongerius, R.. Jastrzebski, P. C. A.. Bruijnincx, B. M.. Weckhuysen, CoMo sulfide-catalyzed hydrodeoxygenation of lignin model compounds: An extended reaction network for the conversion of monomeric and dimeric substrates, J. Catal., 285(1), 315-323(2012).  19. C.. Zhao, J. A.. Lercher, Selective Hydrodeoxygenation of Lignin-Derived Phenolic Monomers and Dimers to Cycloalkanes on Pd/C and HZSM-5 Catalysts, ChemCatChem., 4(1), 64-68(2012).  20. S. B.. Hawthorne, Y.. Yang, D. J.. Miller, Extraction of organic pollutants from environmental solids with sub- and supercritical water, Anal. Chem., 66(18), 2912-2920(1994).  21. H.. Genc, J. C.. Tjell, D.. McConchie, O.. Schuiling, Adsorption of arsenate from water using neutralized red mud, J. Colloid Interface Sci., 264(2), 327-334(2003).  22. S.. Sushil, V. S.. Batra, Catalytic applications of red mud, an aluminium industry waste: A review, Appl. Catal. B: Environ., 81(1-2), 64-77(2008).  23. A.. Agrawal, K. K.. Sahu, B. D.. Pandey, Solid waste management in non-ferrous industries in India, Resour., Conservat. and Recycl., 42(2), 99-120(2004).  24. J.. Pradhan, J.. Das, S.. Das, R. S.. Thakur, Adsorption of Phosphate from Aqueous Solution Using Activated Red Mud, J. Colloid Interface Sci., 204(1), 169-172(1998).  25. M.. Singh, S. N.. Upadhayay, P. M.. Prasad, PREPARATION OF IRON RICH CEMENTS USING RED MUD, Cement and Concrete Res., 27(7), 1037-1046(1997).  26. D. I.. Smirnov, T. V.. Molchanova, The investigation of sulphuric acid sorption recovery of scandium and uranium from the red mud of alumina production, Hydrometallurgy., 45(3), 249-259(1997).  27. R. E.. Browner, The use of bauxite waste mud in the treatment of gold ores, Hydrometallurgy., 37(3), 339-348(1995).  28. J.. Yanik, M. A.. Uddin, K.. Ikeuchi, Y.. Sakata, The catalytic effect of Red Mud on the degradation of poly (vinyl chloride) containing polymer mixture into fuel oil, Polym. Degradat. and Stability73(2), pp. 335-346(2001).  29. P.. Kasliwal, P. S. T.. Sai, Enrichment of titanium dioxide in red mud: a kinetic study, Hydrometallurgy., 53(1), 73-87(1999).  30. Y. H.. Park, Y. N.. Jung, Overview of Bauxite residues and processing status of Domestic and Overseas, Korean Recycl. Construction Resour. Inst., 12(4), 22-27(2017).
31. K. C.. Pratt, V.. Christoverson, Hydrogenation of a model hydrogen-donor system using activated red mud catalyst, Fuel., 61(5), 460-462(1982).  32. A. W. R. J.. Eamsiri, K. C.. Pratt, V.. Christov, M.. Marshall, Activated red mud as a catalyst for the hydrogenation of coals and of aromatic compounds, Fuel., 71(4), 449-453(1992).  33. J. J.. Llano, R.. Rosal, S.. Herminio, F. V.. Díez, Catalytic hydrogenation of anthracene oil with red mud, Fuel., 73(5), 688-694(1994).  34. J.. Alvarez, R.. Rosal, H.. Sastre, F. V.. Diez, Characterization and deactivation studies of an activated sulfided red mud used as hydrogenation catalyst, Appl. Catal. A: General., 167, 215-223(1998).  35. J. R.. Paredes, S.. Ordóñez, A. V. F.. V. and Díez, Catalytic combustion of methane over red mud-based catalysts, Appl. Catal. B: Environ., 47(1), 37-45(2004).  36. A. N.. Stranges, From Birmingham to Billingham: High-Pressure Coal Hydrogenation in Great Britain, Technol. and Culture., 26(4), 726-757(1985).  37. A.. López, I. de.. Marco, B. M.. Caballero, M. F.. Laresgoiti, A.. Adrados, A.. Aranzabal, Catalytic pyrolysis of plastic wastes with two different types of catalysts: ZSM-5 zeolite and Red Mud, Appl. Catal. B: Environ., 104(3-4), 211-219(2011).  38. J. S.. Park, J. Y.. Kim, J. H.. Choi, Degradation of Plant Lignin with the supercritical Ethanol and Ru/C Catalyst Combination for lignin-oil, J. Korean Wood Sci. Technol., 43(3), 355-363(2015).  39. C. S.. Theegala, J. S.. Midgett, Hydrothermal liquefaction of separated dairy manure for production of bio-oils with simultaneous waste treatment, Bioresour. Technol., 107, 456-463(2012).  40. M.. Saidi, F.. Samimi, D.. Karimipourfard, T.. Nimmanwudipong, B. C.. Gates, R. R.. Mohammad, Upgrading of ligninderived bio-oils by catalytic hydrodeoxygenation, Energy and Environ. Sci., 7(1), 103-129(2014).  41. X. J.. Shen, P. L.. Huang, J. L.. Wen, R. C.. Sun, A facile method for char elimination during base-catalyzed depolymerization and hydrogenolysis of lignin, Fuel Proc. Technol., 167, 491-501(2017).  42. J. J.. Li, J.. Zhang, S.. Zhang, Q.. Gao, J.. Li, W.. Zhang, Alkali lignin depolymerization under eco-friendly and cost-effective NaOH/urea aqueous solution for fast curing bio-based phenolic resin, Ind. Crops and Prod., 120, 25-33(2018).  43. R.. Chaudhary, P. L.. Dhepe, Solid base catalyzed depolymerization of lignin into low molecular weight products, Green Chem., 19(3), 778-788(2017). 
|
|














