The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
염화아연 전처리를 통해 제조된 커피잔재물 바이오차와 분말활성탄의 의약품 흡착능 비교
Abstract
Objectives
The main objective of this study was to identify the feasibility of ZnCl2 pre-treated biochar derived from coffee residues (C-biochar) as a potential adsorbent for the removal of the pharmaceuticals (i.e., ibuprofen (IBF), atenolol (ATE), and carbamazepine (CBZ)) from wastewater.
Methods
The removal efficiencies of IBF, ATE, and CBZ by C-biochar and powdered activated carbon (PAC) were compared under different pH (3 ~ 9), temperature (15 ~ 45℃), and ionic strength (0 ~ 0.5 M) conditions and directly correlated to their physicochemical properties to provide deeper insights into the removal mechanisms of the pharmaceuticals by the adsorption processes.
Results and Discussion
C-biochar was more effective for the removal of IBF and CBZ compared to PAC since it showed the greater surface area (C-biochar = 1048.2 m2/g; PAC = 957.6 m2/g) and pore volume (C-biochar = 1.044 cm3/g; PAC = 0.676 cm3/g). However, the removal efficiency of ATE by PAC was higher than that of ATE by C-biochar due to the differences in their function group composition. The Freundlich isotherm model was well fitted to the adsorption of the selected pharmaceuticals by C-biochar and PAC compared with the Langmuir isotherm model. The removal of IBF and ATE by C-biochar and PAC varied substantially depending on the pH of the solutions as their adsorption phenomena were mainly governed by the electrostatic interaction whereas the effects of pH on the removal of CBZ were not significant because of its high pKa value (14). Furthermore, the adsorption of all the selected pharmaceuticals by C-biochar and PAC was found to be independent of the solution ionic strength.
Conclusions
This study demonstrated that C-biochar may be utilized as a potential adsorbent for the effective removal of the pharmaceuticals from wastewater due to the greater surface area and pore volume compared to PAC. The removal of IBF, ATE, and CBZ by C-biochar and PAC was strongly influenced by the physicochemical properties of the pharmaceuticals and adsorbents.
Key words: Adsorption, Biochar, Coffee Residue, Pharmaceuticals, Powdered Activated Carbon
요약
목적
본 연구에서는 커피잔재물을 염화아연으로 활성화하여 제조한 Biochar (C-biochar)를 의약품(i.e., Ibuprofen (IBF), Atenolol (ATE), Carbamazepine (CBZ)) 제거를 위한 흡착제로서 적용 가능성을 상용화된 분말활성탄(PAC: Powdered Activated Carbon)과의 비교를 통해 평가하였다.
방법
본 연구에서는 2가지 흡착등온식 모델을 이용하여 C-biochar와 PAC에 의한 미량오염물질의 제거기작을 조사하였다. 또한, 다양한 변수들이 미량오염물질 흡착에 미치는 영향을 알아보기 위하여 pH (3~9), 온도(15~45℃) 및 이온강도(0~0.5 M) 조건들을 변화시키면서 흡착실험을 수행하였다.
결과 및 토의
C-biochar는 PAC보다 더 넓은 비표면적(C-biochar = 1048.2 m2/g; PAC = 957.6 m2/g)과 공극(C-biochar = 1.044 cm3/g; PAC = 0.676 cm3/g)이 잘 발달되어 IBF와 CBZ의 제거율이 높았지만, PAC보다 표면작용기가 다양하지 않아 ATE의 제거율은 낮았다. 이를 통해 흡착제와 흡착질의 물리화학적 속성과 수용액 조건에 따라 제거율이 좌우된다는 것을 확인할 수 있었다. 등온흡착실험 결과를 통해 C-biochar와 PAC에 의한 대상 의약품의 제거는 Langmuir 등온흡착모델보다 Freundlich 등온흡착모델에 적합한 것으로 보아 다층흡착에 대한 특성을 나타내었다. C-biochar에 의한 IBF와 ATE의 제거는 정전기적 상호작용에 의해 이루어졌기 때문에 pH의 변화에 따라 크게 달라졌지만, CBZ는 pKa가 높아 pH의 영향을 받지 않았다. C-biochar에 의한 대상 의약품 제거에 온도가 미치는 영향은 IBF는 온도에 영향을 받지 않았으며, ATE과 CBZ은 흡열반응으로 온도가 증가함에 따라 제거율이 증가하였다. pH와 온도와 달리, 이온강도 경우 C-biochar와 PAC에 의한 대상 의약품 제거에 일관된 영향을 미치지 않는 것으로 나타났다. C-biochar는 PAC와 비교하였을 때 대상 의약품 제거에 대해 현저한 차이가 없는 것을 확인할 수 있었다.
결론
본 연구는 ZnCl2 전처리를 통한 커피잔재물로부터 우수한 표면특성을 갖는 Biochar를 제조할 수 있다는 것을 입증하였다. 또한 C-biochar와 PAC의 의약품 제거 메커니즘을 다양한 조건에서 알아본 결과 의약품의 물리화학적 속성들과 흡착제의 특징에 따라 달라진다는 것을 확인할 수 있었다.
주제어: 흡착, 바이오차, 커피잔재물, 의약품, 분말활성탄
1. 서 론
의약품은 사람의 건강과 활동에 대한 관심이 높아지면서 사용량이 증가하였지만 사람 및 동물의 체내에 완전히 흡수되지 않아 일부가 대사산물의 형태로 배출되기 때문에 다양한 수계에서 검출되어 큰 문제로 인식되고 있다. 수계에서 발견되는 다양한 의약품 중에서 대표적인 것으로는 Ibuprofen (IBF), Atenolol (ATE)과 Carbamazepine (CBZ) 등이 있다. IBF은 비스테로이드성 항염증제로 진통, 해열을 치료하기 위한 용도로 처방되고 ATE은 고혈압, 부정맥에 사용되는 베타차단제로 사용되며 CBZ은 항경련제로 간질과 신경통의 치료를 위해 널리 이용된다. 수계로 유입된 의약품은 아주 낮은 농도(µg/L – ng/L)로 존재함에도 불구하고, 생물농축에 의해 수생태계에 직접적 또는 간접적으로 교란을 일으킬 수 있고, 급성 또는 만성 독성을 유발할 수 있어 임산부, 노약자 또는 영유아와 같이 면역력이 약한 사람들에게 위험하다. 이에 따라, 수계에 존재하는 의약품은 적절한 기술을 통해 처리가 필요한 실정이다[ 1~ 4]. 기존의 생물학적 하수처리공정들은 유기물 및 부유물질 제거에는 효과적이지만 의약품은 잘 제거하지 못하는 것으로 알려져 있다. 이에 따라 산화, 흡착과 막여과와 같은 고도처리 공정들이 하수처리에 적용되는 사례가 증가하고 있다[ 5~ 8]. 다른 공정들에 비해 활성탄을 이용한 흡착공정은 의약품을 효과적으로 제거하면서도 유지와 관리가 용이하다는 장점이 있는 것으로 알려져 있다. 하지만, 활성탄을 이용한 흡착공정은 주기적으로 교체가 필요하기 때문에 실제 수처리 적용의 한계가 있다는 문제점이 있다. Biochar는 활성탄을 대체할 수 있는 유망한 흡착제로 인식되고 있다. Biochar는 땅콩껍질, 사탕수수 착즙 부산물, 쌀겨, 톱밥 등과 같은 값이 저렴한 농업부산물을 원료로 사용하여 산소가 제한된 조건에서 열분해하여 얻어지는 탄소성 물질로서 폐기물 발생량을 감소시키면서 동시에 고부가가치 자원으로 전환시켜줄 수 있다는 장점이 있다[ 9~ 11]. 또한, Biochar는 우수한 비표면적, 공극구조, 다양한 표면작용기와 높은 양이온 교환능과 같은 특징을 가지기 때문에 폐기물 관리, 토양 개선, 에너지 생산과 기후변화 완화와 같이 다양한 분야에서 연구되고 있다. 이러한 특징은 Biochar의 활성화 방법, 원료와 열분해조건에 따라 달라진다. 높은 열분해 온도는 유기화합물의 흡착효율을 증가시키는 높은 다공성 구조를 Biochar에 형성시키지만 활성탄보다 상대적으로 낮은 비표면적과 부피를 갖는 한계가 있다. 이러한 Biochar의 단점을 보완하기 위해 탈수제를 이용한 화학적 활성화가 연구되었으며, 다양한 탈수제 중에서 염화아연이 탈수제로 가장 널리 적용되어왔다. 염화아연을 통한 화학적 활성화는 탄소 구조의 공극개발을 증진시키며 생산량을 높여준다[ 12~ 15]. 커피는 세계적으로 두 번째로 많이 거래되는 기호성 상품 중 하나로써 소비량이 증가함에 따라 커피잔재물 발생량이 크게 증가하고 있는 실정이다. 이로 인해 지속적으로 발생하는 커피잔재물 처리는 문제가 될 것으로 판단된다. 이러한 커피잔재물은 지방산, 리그닌, 셀루로오스, 헤미셀룰로오스와 같은 다양한 유기탄소 성분을 포함하고 있어 열처리하여 사용할 경우 환경매체로서 이점이 있다. 커피잔재물은 또한 O-H, C=O와 C-N과 같은 작용기를 포함하고 있어, 수처리용 Biochar의 원료로써 이용 가치가 높은 것으로 보고되었다[ 16, 17]. 하지만, 커피잔재물을 활용하여 생산된 Biochar의 연구는 중금속 흡착에 대해서는 많은 연구가 진행되었지만, 의약품 제거연구에는 드물게 적용되고 있어, 이에 대한 연구는 아직 부족한 편이다[ 18, 19]. 본 연구에서는 염화아연 전처리를 통한 커피잔재물 Biochar의 의약품 제거 가능성을 평가하기 위하여 상용화된 분말활성탄의 의약품 물리화학적 특성(원소분석과 표면분석)과 제거효율을 비교하였다. 의약품 흡착특성을 판단하기 위해 초기 농도를 변화시키면서 2가지 흡착등온식 모델을 적용하였고, pH, 온도와 이온강도와 같은 다양한 변수들이 흡착에 미치는 영향을 확인하였다.
2. 재료 및 방법
2.1. 재료
본 연구에 이용된 커피잔재물은 춘천(강원도, 대한민국)에 위치한 커피숍으로부터 제공받았다. 대상 미량오염물질들(IBF, ATE과 CBZ)은 Sigma-Aldrich (St Louis, Missouri, USA)에서 구매되었으며, 물리화학적 특성과 화학적 구조는 Table 1과 같다. 염화아연(ZnCl 2), 염산(HCl), 수산화나트륨(NaOH), 염화나트륨(NaCl) 및 메탄올은 대정화금(시흥시, 경기도, 대한민국)에서 구매하였다.
2.2. Biochar 생산
커피잔재물은 Deionized (DI) water를 이용해 수회 세척하였고, 수분을 제거하기 위해 12시간 동안 105℃에서 오븐 건조하였다. 건조한 커피잔재물과 분말형태의 ZnCl2은 1:3(커피잔재물:ZnCl2)의 비율로 5 ~ 10 mL의 DI water를 사용해 혼합하여 전처리하였으며 12시간 동안 105℃에서 오븐 건조하였다. 전처리한 커피잔재물은 Tubular Furnace (PyroTech, 남양주, 경기도, 대한민국)에서 N2 가스(0.5 L/min)를 이용하여 산소가 제한된 조건에서 600℃까지 10℃/min으로 가열하고 4시간 동안 열분해하여 Biochar로 생산한 후 상온까지 방냉하였다. 생산된 Biochar에 남아있는 불순물(아연과 염소이온)을 제거하기 위해 200 mL의 DI water, 0.1 N HCl과 뜨거운 DI water (80℃)를 이용하여 순차적으로 세척한 후 12시간 동안 105℃에서 오븐 건조하였다. 건조한 Biochar는 100-mesh체를 이용해 균일한 크기로 분리한 후 데시케이터에 보관하였다. 위와 같은 준비과정을 통해 coffee residues-biochar를 C-biochar로 명명하였다. C-biochar의 의약품 제거효율을 평가하기 위해 분말 활성탄(PAC: Powdered Activated Carbon)으로는 Darco® - 100 mesh particle size (Sigma-Aldrich, St Louis, Missouri, USA)을 이용하였다.
2.3. 흡착제 특성분석
C-biochar와 PAC의 표면특성(비표면적, 총 공극부피와 평균 공극직경)은 Brunauer Emmett Teller (BET) analyzer (BELSORP-mini II, MicrotracBEL, Osaka, Japan)를 이용해 측정하였다. 흡착제의 비표면적과 총 공극직경은 BET방정식을 통해 계산되었고, 총 공극부피는 Barrett-Joyner-Halenda 방법을 통해 결정되었으며, P/P0 = 0.99에서 흡착된 질소량을 통해 계산되었다. 흡착제의 표면 작용기는 KBr 가압정제법을 적용하여 4000 cm-1에서 400 cm-1의 파장범위에서 Fourier transform infrared (FTIR) spectroscopy (Frontier Optica, Perkin Elmer, Waltham, MA, USA)을 통해 분석하였다. 각 흡착제의 원소함량은 Elemental analyzer (EuroEA3000 CHNS-O, EuroVector S.p.A, Via Tortona, Milan, Italy)를 사용해 분석되었다. 회분함량은 흡착제의 전체 질량분율로부터 탄소(C), 수소(H), 질소(N)와 산소(O)의 함량을 뺌으로써 계산되었다. 원소분석을 통해 얻은 결과를 기초로 하여, H/C, O/C와 N/C의 비를 산출해 방향성 및 극성을 유추하였다.
2.4. 회분식 흡착 연구
본 연구에서는 50 mg의 IBF, ATE과 CBZ를 25 mL 메탄올에 용해시킨 후 DI water를 첨가하여 1 g/L의 Stock solution을 제조한 후 알맞게 희석하여 흡착실험에 사용하였다. 모든 실험은 Shaking incubator (VS-8480, 비전과학, 대전시, 대한민국)를 이용하여 진행되었으며, 동일한 조건(the initial concentration each micropollutant = 10 mg/L; temperature = 25℃; adsorbent dose = 50 mg/L; agitation speed: 200 rpm; agitation time = 30 min)으로 수행되었다. 등온흡착실험은 C-biochar와 PAC의 최대 흡착능을 평가하기 위해 대상 미량오염물질의 초기농도(10 ~ 100 mg/L)를 변화시키면서 48시간 동안 수행하였다(pH = 7). 미량오염물질 흡착에 용액의 초기 pH가 미치는 영향을 알아보기 위해 0.1 N HCl과 NaOH를 이용하여 pH 3 ~ 9의 범위로 조절하여 진행하였다. 온도를 15 ~ 45℃로 조절하여 용액의 온도가 미량오염물질 흡착에 미치는 영향을 알아보기 위해 회분식 흡착 실험을 수행하였다. NaCl을 사용하여 용액의 이온강도를 조절하여 이온강도가 미량오염물질 제거에 미치는 영향을 판단하기 위해 회분식 흡착 실험을 진행하였다(NaCl = 0~0.5 M).
2.5. 의약품의 분석
반응이 종료된 각 용액은 0.7 µm GF/F filter (Whatman, Maidstone, UK)를 사용하여 흡착제와 분리하였다. 원수 및 처리수의 IBF, ATE, CBZ 농도는 UV-Vis Spectrophotometer (UV-1280, Shimadzu, Kyoto, Japan)를 이용하여 각각 264 nm (Detection limit of IBF = 0.034 mg/L), 274 nm (Detection limit of ATE = 0.041 mg/L), 284 nm (Detection limit of CBZ = 0.010 mg/L)에서 측정하였다[ 20~ 22]. 초기와 나중 농도에서부터, 흡착된 의약품의 양, Q e (mg/g)은 다음 식 (1)을 통해 계산하였다. 여기서, C0와 Ce (mg/L)는 각각, 초기와 평형에서 의약품 용액의 농도, V는 용액의 부피(L), mAC는 실험에 사용된 흡착제의 양(g)이다.
등온흡착실험결과는 Langmuir와 Freundlich 모델을 적용하여 적합성을 판단하였다. Langmuir 등온식은 다음 식 (2)와 같다. 여기서 C e (mg/L)와 Q e (mg/g)는 각각 평형에서 의약품의 농도와 흡착된 의약품의 양이며, Q max (mg/g)와 K L (L/g)은 흡착제 표면에 단분자층을 형성하는 최대 흡착량과 결합세기와 관련된 Langmuir 상수이다. Langmuir 등온식의 선형식은 식 (2)에 역수를 취하여 다음 식 (3)과 같이 표현된다. Freundlich 등온식은 다음 식 (4)와 같다. 여기서, K F (mg 1-1/ nL 1/n/g)와 n은 각각 Freundlich 상수와 지수이다. Freundlich 등온식의 선형식은 식 (4)의 양변에 Log를 취하여 다음 식 (5)과 같이 표현된다.
3. 결과 및 고찰
3.1. 흡착제 특성분석
Fig. 1은 C-biochar와 PAC의 표면작용기에 대한 분석 결과를 나타내고 있다. C-biochar와 PAC의 표면작용기 구성은 유사하였으나, PAC가 더 다양한 표면작용기를 포함하고 있었다. PAC는 C-H aromatics (C-biochar = 806 cm -1; PAC = 805 cm -1)의 IR peak 강도가 C-biochar보다 높았고, C-biochar는 PAC보다 더 강한 N-H amides (C-biochar = 1596 cm -1; PAC = 1568 cm -1)의 IR peak 강도를 나타내었으며, C-biochar와 PAC의 C-N amines (C-biochar = 1261 cm -1; PAC = 1259 cm -1) IR peak 강도는 비슷한 것으로 나타났다. 그리고 추가적으로 C-O-C ether (1097 cm -1), C-O ester (1741 cm -1) 및 O-H alcohols (3406 cm -1)의 IR peak가 PAC에서 발견되었다[ 23]. C-biochar와 PAC의 원소성분과 표면특성 분석결과는 Table 2에 나타내었다. C-biochar의 극성(O/C+N/C)은 PAC보다 높았으며 방향성(H/C)은 PAC보다 낮았다. 이러한 결과는 FTIR 분석결과와 일치하는 것으로 확인되었다. 또한, BET 분석결과를 통해 C-biochar가 PAC보다 비표면적(C-biochar = 1048.2 m 2/g, PAC = 957.6 m 2/g), 총 공극부피(C-biochar = 1.044 cm 3/g, PAC = 0.676 cm 3/g)와 평균 공극직경(C-biochar = 39.85 Ȧ, PAC = 28.25 Ȧ)이 모두 크다는 사실을 확인할 수 있었다.
3.2. 등온흡착실험
C-biochar와 PAC를 통한 의약품의 등온흡착 실험결과값은 Table 3에 나타낸 바와 같다. 두 가지의 흡착등온식을 통한 의약품 흡착특성을 비교한 결과, IBF, ATE와 CBZ은 단층 흡착의 특성을 가진 Langmuir 등온식(R 2 of C-biochar = 0.944 – 0.993; R 2 of PAC = 0.934 – 0.970)보다 다층 흡착의 특성을 가진 Freundlich 등온식(R 2 of C-biochar = 0.986 – 0.997; R 2 of PAC = 0.984 – 0.989)에 적합하였다. Freundlich 등온식의 흡착 선호도는 n > 1이면 선호적이고 n < 1이면 흡착공정이 일반적으로 화학적 흡착성향을 가지는데 본 연구에 이용된 모든 의약품들의 n값은 1보다 크므로 흡착이 선호적인 것으로 판단되었다. C-biochar와 PAC에 대한 최대 흡착량(Q max)은 두 흡착제 모두 IBF (C-biochar = 312.5 mg/g; PAC = 294.1 mg/g) < CBZ (C-biochar = 384.6 mg/g; PAC = 357.1 mg/g) < ATE (C-biochar = 434.8 mg/g; PAC = 526.3 mg/g) 순으로 높았으며, 각 의약품의 최대흡착량은 큰 차이가 없었다. C-biochar의 미량오염물질 최대흡착능을 기존 연구결과들과 비교한 결과( Table 4), IBF의 경우 소나무 조각으로 만든 Biochar (311.0 mg/g)보다 높았지만, Steam과 K 2CO 3로 복합 개질한 PAC (393.4 mg/g)에 비해 조금 낮은 것으로 나타났다[ 24, 25]. ATE의 경우 인산으로 활성화한 나무 계열의 활성탄(49.1 mg/g)보다 크게 높았고, KOH로 개질한 Biochar (500.0 mg/g)보다 상대적으로 낮은 것을 확인할 수 있었고, CBZ의 경우 C-biochar가 기존 연구에서 보고된 대부분의 Biochar보다 높은 최대 흡착량을 가지는 것으로 나타났다[ 26~ 29]. 이러한 결과를 통해, 본 연구에서 생산된 C-biochar는 IBF, ATE과 CBZ을 포함한 실제 폐수 처리시 적용될 수 있다고 사료된다.
3.3. pH의 영향
Fig. 2는 C-biochar와 PAC에 의한 의약품 흡착이 용액의 초기 pH에 의해 받는 영향을 알아보기 위해 용액의 pH (3 ~ 9)를 다양하게 변화시키면서 수행한 결과를 나타내었다. C-biochar와 PAC에 의한 IBF와 ATE 제거는 pH 변화에 영향을 받았지만, CBZ 제거는 pH 변화에 영향을 받지 않았다. C-biochar와 PAC에 의한 IBF의 제거율은 pH가 감소함에 따라 증가되어 pH 3에서 가장 높은 제거율(43.8%)을 나타냈다. 이와 반대로, pH가 IBF의 p Ka (4.91)보다 높아지면 흡착제와 IBF 사이의 음전하에 의한 정전기적 척력의 증가로 인하여 IBF 제거율이 감소하였다. 이러한 결과는 C-biochar와 PAC에 의한 IBF의 흡착의 경우 pH에 크게 영향을 받는 것을 의미한다[ 25]. C-biochar에 의한 높은 IBF 제거율은 C-biochar가 PAC보다 더 높은 극성(C-biochar = 0.111; PAC = 0.049)과 넓은 비표면적(C-biochar = 1048.2 m 2/g; PAC = 957.6 m 2/g)을 가지기 때문으로 판단된다. C-biochar와 PAC에 의한 ATE 제거는 pH가 증가함에 따라 흡착제 표면전하는 더 음전하로 하전되어 양전하를 띄고 있는 ATE와의 정전기적 인력이 증가함에 따라 높아졌다[ 30]. PAC에 의한 높은 ATE 제거율은 ATE에 존재하는 N-H 작용기와 PAC에만 존재하는 O-H와 C-O 작용기와 수소결합을 형성하였기 때문으로 사료된다. IBF와 ATE와 달리, CBZ은 높은 p Ka (14)로 인해 pH 3 ~ 9 범위에서는 해리되지 않아 C-biochar와 PAC에 의한 CBZ 제거는 pH 변화에 대한 영향이 없음을 확인할 수 있었다. 따라서, C-biochar와 PAC에 의한 CBZ 제거는 전기적인 상호작용보다 소수성 상호작용에 의해서 주로 이루어졌다고 판단된다. C-biochar에 의한 더 높은 CBZ 제거는 더 넓은 비표면적(C-biochar = 1048.2 m 2/g; PAC = 957.6 m 2/g)을 가지므로 PAC보다 더 높은 제거율을 나타냈다.
3.4. 온도의 영향
Fig. 3은 용액의 온도가 C-biochar와 PAC에 의한 의약품 흡착에 미치는 영향을 알아보기 위하여 4가지 다른 온도조건(15 ~ 45℃)에서 회분식 실험을 수행한 결과를 나타내었다. C-biochar와 PAC에 의한 IBF 제거는 온도변화에 영향을 받지 않았지만, ATE와 CBZ 제거는 온도변화에 영향을 받았다. C-biochar와 PAC에 의한 IBF 제거가 온도변화에 영향을 받지 않은 이유는 IBF 분자들이 흡열에너지를 동반한 dehydration 과정을 통해 hydration sheath을 잃어 잘 용해되고, 이때 흡열에너지는 IBF분자가 흡착제 표면에 붙기 위한 발열에너지와 동일하기 때문이라고 판단된다[ 31]. C-biochar에 의한 더 높은 IBF 제거율은 PAC대비 C-biochar의 더 높은 극성(C-biochar: 0.111; PAC: 0.049)과 넓은 비표면적(C-biochar = 1048.2 m 2/g; PAC = 957.6 m 2/g) 때문으로 사료된다. C-biochar와 PAC에 의한 ATE과 CBZ 제거율이 온도가 증가함에 따라 증가된 이유는 ATE과 CBZ은 Gibbs free energy (∆Gº) 값이 양의 값을 가지는 흡열반응이기 때문이다[ 30, 32]. C-biochar는 PAC보다 더 높은 극성(C-biochar = 0.111; PAC = 0.049)과 비표면적(C-biochar = 1048.2 m 2/g; PAC = 957.6 m 2/g)으로 인해 CBZ 제거율이 높았지만, PAC보다 표면작용기가 다양하지 않아 ATE 제거율은 낮은 것을 확인할 수 있었다.
3.5. 이온강도의 영향
이온강도가 C-biochar와 PAC에 의한 의약품 제거에 미치는 영향은 Fig. 4에 나타냈다. C-biochar와 PAC에 의한 의약품 제거는 이온강도의 영향을 받지만 일관된 경향을 나타내진 않았다. 각 이온강도에서 C-biochar에 의한 의약품 제거는 CBZ > IBF > ATE 순으로, PAC에 의한 흡착은 CBZ > ATE > IBF 순으로 높게 나타났다. 일반적으로 이온강도가 증가할 경우, 흡착제는 서로 뭉쳐지려 하며, 흡착제와 흡착질의 서로 다른 표면 전하로 인한 정전기적 척력은 감소하게 되지만, C-biochar와 PAC를 이용한 의약품 제거는 이온강도에 따라 일관된 경향이 나타나지 않았다. 이러한 결과는 NaCl을 이용해 이온강도를 조절한 Triclosan 흡착에 기존의 연구와 일치하는 것을 확인하였다[ 33].
4. 결 론
본 연구는 ZnCl2 전처리를 통한 커피잔재물로부터 우수한 표면특성을 갖는 Biochar를 제조할 수 있다는 것을 입증하였다. 또한 C-biochar와 PAC의 의약품 제거 메커니즘을 다양한 조건에서 알아본 결과 의약품의 물리화학적 속성들과 흡착제의 특징에 따라 달라진다는 것을 확인할 수 있었다. 본 연구의 주요 결론은 다음과 같다.
1) ZnCl2에 의해 활성화된 C-biochar가 PAC보다 더 낮은 방향성을 가지지만, 더 큰 비표면적과 높은 극성을 가짐을 알 수 있었다.
2) IBF, CBZ, ATE는 다층 흡착특성을 갖는 Freundlich 등온식에 적합하였으며, C-biochar와 PAC에 의한 최대흡착량은 모두 IBF < CBZ < ATE 순으로 높게 나타났다. 의약품 흡착은 pH와 온도에 대해서는 영향을 받았으며, 이온강도에 대한 영향은 일관되게 나타나지 않았음을 확인하였다.
3) Biochar의 물리화학적 속성은 활성화 방법의 전처리와 후처리에 따라 달라지기 때문에 약품 제거율을 높일 수 있는 Biochar의 개질에 적합한 조건을 찾는 연구가 더 필요하다고 판단된다.
Acknowledgments
본 연구는 환경부의 재원으로 한국환경산업기술원의 플랜트연구사업의 지원을 받아 연구되었습니다(1485016265).
Fig. 1.
The FTIR spectra of C-biochar and PAC. 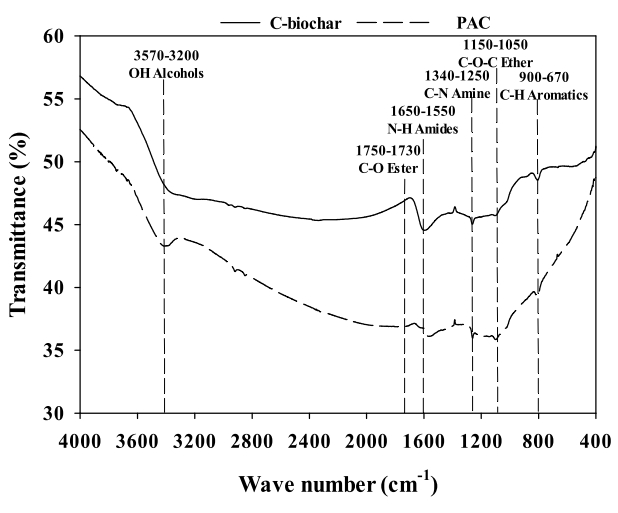
Fig. 2.
Effects of pH on the removal of the pharmaceuticals: (a) C-biochar and (b) PAC (agitation speed = 200 rpm, agitation time = 30 min, adsorbent dose = 50 mg/L, and temperature = 25℃). 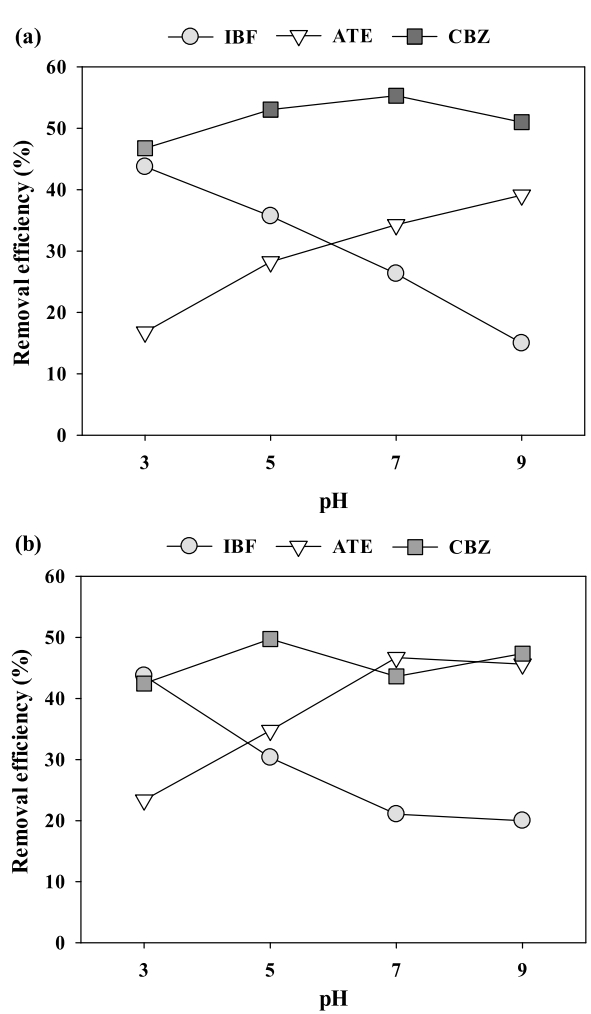
Fig. 3.
Effects of temperature on the removal of the pharmaceuticals: (a) C-biochar and (b) PAC (agitation speed = 200 rpm, agitation time = 30 min and adsorbent dose = 50 mg/L). 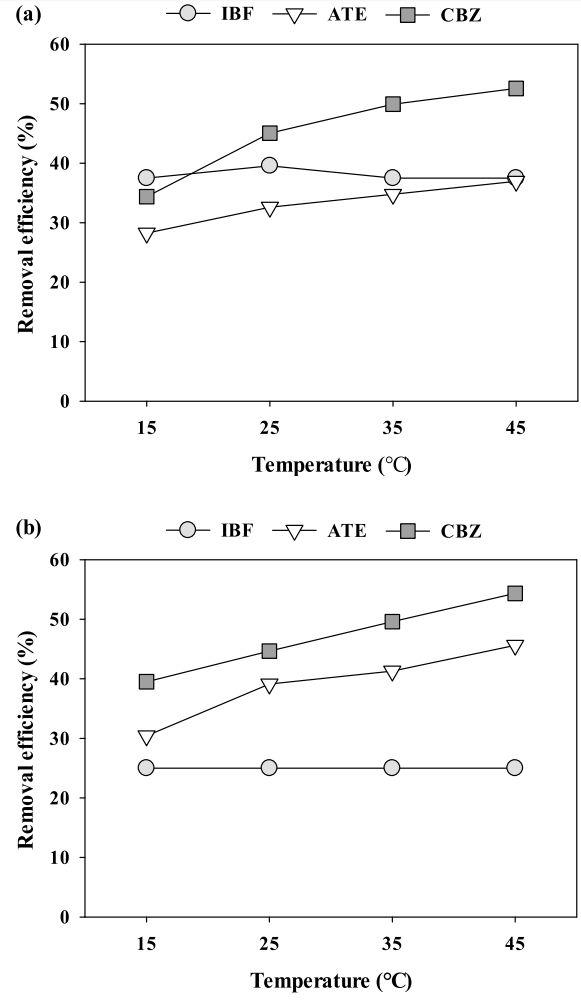
Fig. 4.
Effects of ionic strength on the removal of the pharmaceuticals: (a) C-biochar and (b) PAC (agitation speed = 200 rpm, agitation time = 30 min, adsorbent dose = 50 mg/L, and temperature = 25℃). 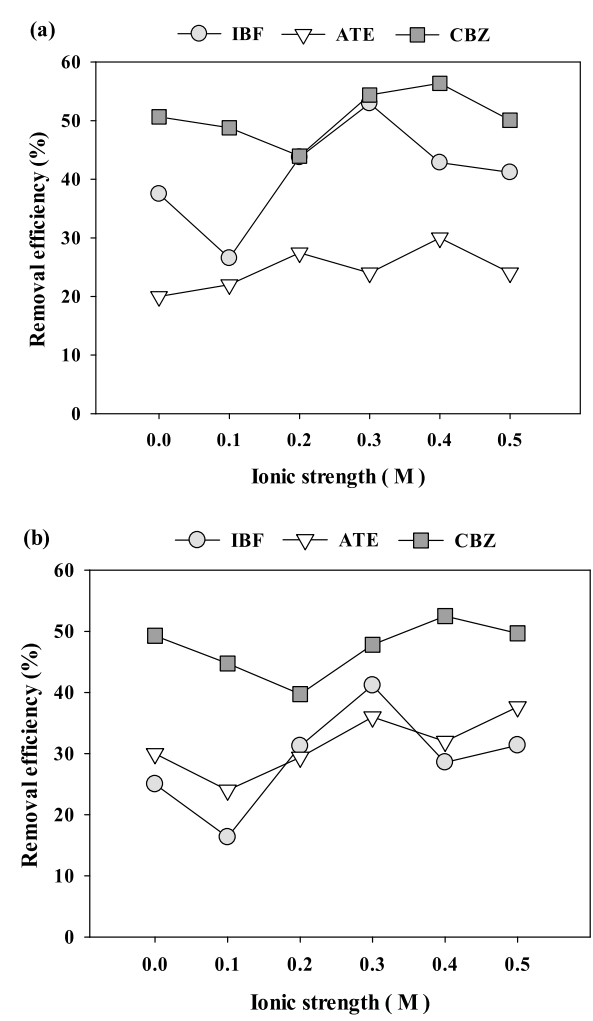
Table 2.
Physicochemical properties of the adsorbents.
|
C (%) |
H (%) |
O (%) |
N (%) |
Ash (%) |
H/C |
O/C |
N/C |
SBET (m2/g) |
Pore volume (cm3/g) |
D (Ȧ) |
|
C-biochar |
79.42 |
2.09 |
5.93 |
2.88 |
9.68 |
0.026 |
0.075 |
0.036 |
1048.2 |
1.044 |
39.85 |
|
PAC |
85.02 |
0.76 |
3.86 |
0.32 |
10.04 |
0.009 |
0.045 |
0.004 |
957.6 |
0.676 |
28.25 |
Table 3.
Isotherm parameters for the removal of the pharmaceuticals using C-biochar and PAC.
|
Type of Adsorbents |
Compounds |
Langmuir
|
Freundlich
|
|
Qmax
|
KL
|
R2
|
n |
KF
|
R2
|
|
C-biochar |
IBF |
312.5 |
0.119 |
0.984 |
4.42 |
104.9 |
0.986 |
|
ATE |
434.8 |
0.019 |
0.944 |
1.64 |
18.6 |
0.997 |
|
CBZ |
384.6 |
0.098 |
0.993 |
3.22 |
92.3 |
0.995 |
|
PAC |
IBF |
294.1 |
0.043 |
0.960 |
2.29 |
34.0 |
0.989 |
|
ATE |
526.3 |
0.031 |
0.934 |
1.95 |
41.3 |
0.989 |
|
CBZ |
357.1 |
0.052 |
0.970 |
2.55 |
52.2 |
0.984 |
Table 4.
Comparison of the adsorption capacity of micropollutants on different adsorbents.
|
Adsorbents |
Compounds |
Adsorption capacity (mg/g) |
References |
|
NaOH-Pinewood chip |
IBF |
311.0 |
[24] |
|
Steam-K2CO3-PAC |
IBF |
393.4 |
[25] |
|
H3PO4-PAC |
ATE |
49.1 |
[26] |
|
KOH-apple tree branch |
ATE |
500.0 |
[27] |
|
NaOH-Pomelo peel |
CBZ |
286.5 |
[28] |
|
Pinewood biochar |
CBZ |
116.0 |
[29] |
References
1. H. M. Jang, S. Yoo, S. Park, E. Kan, Engineered biochar from pine wood: Characterization and potential application for removal of sulfamethoxazole in water, Environ. Eng. Res., 24(4), 608-617(2019).  2. V. Koutsouba, Th. Heberer, B. Fuhrmann, K. Schmidt-Baumler, D. Tsipi, A. Hiskia, Determination of polar pharmaceuticals in sewage water of Greece by gas chromatography-mass spectrometry, Chemosphere., 51(2), 69-75(2003).  3. Y. M. Yoon, P. Westerhoff, S. A. Snyder, E. C. Wert, Nanofiltration and ultrafiltration of endocrine disrupting compounds, pharmaceuticals and personal care products, J. Membrane. Sci., 270(1-2), 88-100(2006).  4. O. A. H. Jones, N. Voulvoulis, J. N. Lester, Aquatic environmental assessment of the top 25 English prescription pharmaceuticals, Water Res., 36, 5013-5022(2002).  5. Z. Shu, J. R. Bolton, M. Belosevic, M. G. E. Din, Photodegradation of emerging micropollutants using the medium-pressure UV/H2O2 Advanced Oxidation Process, Water Res., 47(8), 2881-2889(2013).  6. A. Joss, S. Zabczynski, A. Gobel, B. Hoffmann, D. Löffler, C. S. McArdell, T. A. Ternes, A. Thomsen, H. Siegrist, Biological degradation of pharmaceuticals in municipal wastewater treatment: Proposing a classification scheme, Water Res., 40(8), 1686-1696(2006).  7. A. J. C. Semiāo, A. I. Schäfer, Estrogenic micropollutant adsorption dynamics onto nanofiltration membranes, J. Membrane. Sci., 381(1-2), 132-141(2011).  8. R. Mailer, J. Gasperi, Y. Coquet, C. Derome, A. Buleté, E. Vulliet, A. Bressy, G. Varrault, G. Chebbo, V. Rocher, Removal of emerging micropollutants from wastewater by activated carbon adsorption: Experimental study of different activated carbons and factors influencing the adsorption of micropollutants in wastewater, J. Environ. Chem. Eng., 4(1), 1102-1109(2016).  9. P. Gupta, T. W. Ann, S. M. Lee, S. M. Lee, Use of biochar to enhance constructed wetland performance in wastewater reclamation., 21(1), 36-44(2016).
10. J. B. Castro, P. R. Bonelli, E. G. Cerrella, A. L. Cukierman, Phosphoric acid activation of agricultural residues and bagasse from sugar cane: Influence of the experimental conditions on adsorption characteristics of activated carbon, Ind. Eng. Chem. Res., 39(11), 4166-4172(2000).  11. Y.-K. Choi, H. M. Jang, E. Kan, A. R. Wallace, W. Sun, Adsorption of phosphate in water on a novel calcium hydroxide-coated dairy manure-derived biochar, Environ. Eng. Res., 24(3), 434-442(2019).  12. P. Chingombe, B. Saha, R. J. Waleman, Surface modification and characterization of a coal-based activated carbon, Carbon., 43(15), 3132-3143(2005).  13. M. Ahmad, A. U. Rajapaksha, J. E. Lim, M. Zhang, N. Bolan, D. Mohan, M. Vithanage, S. S. Lee, Y. S. Ok, Biochar as a sorbent for contaminant management in soil and water: A review, Chemosphere., 99, 19-33(2014).  14. Y. Chun, G. Sheng, C. T. Chiou, B. Xing, Compositions and sorptive properties of crop residue-derived chars, Environ. Sci. Technol., 38, 4649-4655(2004).  15. A. Ahmadpour, D. D. Do, The preparation of activated carbon from macadamia nutshell by chemical activation, Carbon., 35(12), 1723-1732(1997).  16. V. Boonamnuaynitaya, C. Chaiya, W. Tanthapanichakoon, S. Jarudilokkul, Removal of heavy metals by adsorbent prepared from pyrolyzed coffee residues and clay, Sep. Purif. Technol., 35, 11-22(2004).  17. W. T. Tsai, S. C. Liu, C.-H. Hsieh, Preparation and fuel properties of Biochars from the pyrolysis of exhausted coffee residue, J. Anal. Appl. Pyrol., 93, 63-67(2012).  18. M. Inyang, B. Gao, Y. Yao, Y. Xue, A. R. Zimmerman, P. Pullammanappallil, X. Cao, Removal of heavy metals from aqueous solution by Biochars derived from anaerobically digested biomass, Bioresource Technol., 110, 50-56(2012).  19. M.-S. Kim, H.-G. Min, N. Koo, J. Park, S.-H. Lee, G.-I. Bak, J.-G. Kim, The effectiveness of spent coffee grounds and its Biochar on the amelioration of heavy metals-contaminated water and soil using chemical and biological assessments, J. Environ. Manage., 146, 124-130(2014).  20. Y.-F. Zhu, J.-L. Shi, Y.-S. Li, H.-R. Chen, W.-H. Shen, X.-P. Dong, Storage and release of IBFprofen drug molecules in hollow mesoporous silica spheres with modified pore surface, Micropor. Mesopor. Mat., 85(1-2), 75-81(2005).  21. P. Rathee, S. Rathee, S. Thakur, V. Kumar, Simultaneous estimation of amlodipine besylate and atenolol as A.P.I. and in tablet dosage forms by vierodt’s method using U.V. spectrophotometry, Der. Pharma. Cehmica., 2(1), 62-68(2010).
22. L. Rizzo, S. Meric, M. Guida, D. Kassinos, V. Belgiorno, Heterogenous photocatalytic degradation kinetics and detoxification of an urban wastewater treatment plant effluent contaminated with pharmaceuticals, Water Res., 43(16), 4070-4078(2009).  23. J. Coates, Interpretation of infrared spectra, a practical approach, Encyclopedia of Analytical Chemistry John Wiley & Sons Ltd pp. 10815-10837(2000).
24. C. Jung, L. K. Boateng, J. R. V. Flora, J. Oh, M. C. Braswell, A. Son, Y. Yoon, Competitive adsorption of selected non-steroidal anti-inflammatory drugs on activated Biochars: Experimental and molecular modeling study, Chem. Eng. J., 264, 1-9(2015).  25. A. S. Mestre, J. Pires, J. M. F. Nogueira, A. P. Carvalho, Activated carbons for the adsorption of Ibuprofen, Carbon., 45(10), 1979-1988(2007).  26. L. F. Delgado, P. Charles, K. Glucina, C. Morlay, Adsorption of ibuprofen and atenolol at trace concentration on activated carbon, Sep. Sci. Technol., 50(10), 1487-1496(2014).  27. S. C. R. Marques, A. S. Mestre, M. Machuqueiro, A. Ž. Gotvajn, M. Marinšek, A. P. Carvalho, Apple tree branches derived activated carbons for the removal of β-blocker atenolol, Chem. Eng. J., 345, 669-678(2018).  28. D. Chen, S. Xie, C. Chen, H. Quan, L. Hua, X. Luo, L. Guo, Activated Biochar derived from pomelo peel as a high-capacity sorbent for removal of carbamazepine from aqueous solution, Roy. Soc. Ch., 7, 54969-54979(2017).  29. M. Naghdi, M. Taheran, R. Pulicharla, T. Rouissi, S. K. Brar, M. Verma, R. Y. Surampalli, Pine-wood derived nanobiochar for removal of carbamazepine from aqueous media: Adsorption behavior and influential parameters, Arab. J. Chem., 9, 1-10(2017).  30. G. Z. Kyzas, A. Koltsakidou, S. G. Nanaki, D. N. Bikiaris, D. A. Lambropoulou, Removal of beta-blockers from aqueous media by adsorption onto graphene oxide, Sci. Total. Environ., 537, 411-420(2015).  31. R. Naseem, S. S. Tahir, Removal of Pb(Ⅱ) from aqueous/acidic solutions by using bentonite as an adsorbent, Water Res., 35(16), 3982-3986(2001).  32. N. Suriyanon, P. Punyapalakul, C. Ngamcharussrivichai, Mechanistic study of diclofenac and carbamazepine adsorption on functionalized silica-based porous materials, Chem. Eng. J., 214(1), 208-218(2013).  33. S. K. Behera, S.-Y. Oh, H.-S. Park, Sorption of triclosan onto activated carbon, kaolinite and montmorillonite: Effects of pH, ionic strength, and humic acid, J. Hazard. Mater., 179(1-3), 684-691(2010). 
|
|