|
The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
AbstractHeavy metals leaching from closed mines have been causing severe environmental problems in nearby soil ecosystems. Mine reclamation in Korea has been recently implemented based on the heavy metal immobilization (a.k.a., stabilization). Since the immobilization temporarily fixes the heavy metals to the soil matrix, the potential risk of heavy metal leaching still exists. Therefore the appropriate monitoring and the related policies are required to safeguard the soils, where all the cultivations occur. The current monitoring methods are based on either heavy metal concentration or simple toxicity test. Those methods, however, are fragmented and hence it is difficult to evaluate the site in an integrated manner. In this study, as the integrated approach, ecological functional state evaluation with a multivariate statistical tool was employed targeting physiochemical soil properties, heavy metal concentrations, microbial enzymatic activity, and arsenic respiratory reductase gene quantity. Total 60 soil samples obtained from three mines (Pungjeong, Jeomdong, Seosung) were analyzed. As a result, the stabilized layer soil and lower layer soil have shown the similar pattern in Pungjeong mine. In contrast, Jeomdong and Seosung mine have shown the similarity between the stabilized layer soil and the cover layer soil, indicating the possible contamination of the cover layer soil.
요약폐광산은 방치된 광미 등으로 인하여 주변환경에 복합적인 중금속 오염을 야기한다. 이를 방지하기 위하여 국내에서는 1990년대 중반부터 석회석 등의 안정화제와 복토를 이용한 안정화 공법을 기반으로 토양개량사업이 시행 중이다. 복원된 토양의 상부에서는 작물의 재배로 인해 중금속이 고정된 안정화 층이 지화학적 변화를 겪게 되며 이에 따른 중금속의 용출 및 이동이 가능하므로 토양개량사업을 마친 토양에 대한 질 평가 등의 사후 관리는 반드시 필요하다. 토양의 질 평가를 하기 위해서는 이화학적 분석 또는 생물학적인 분석을 개별적으로 하기보다는 이들을 결합한 종합적인 분석이 필요하며 이를 통해 토양의 생태기능상태(ecological functional state)를 평가할 수 있다. 본 연구에서는 대상시료로 경상북도 봉화군 풍정 광산, 전라남도 광양시 점동 광산, 충청남도 서산시 서성 광산 인근 안정화 처리 토양과 안정화 처리가 되지 않은 오염, 비오염 토양을 선정하였다. 토양의 이화학적 성질인 pH, CEC, LOI와 중금속 농도를 측정하였고, 미생물 효소활성도와 비소환원유전자를 정량하였다. 다변량 통계분석을 바탕으로 모든 데이터를 분석하여 토양 생태기능상태를 평가하였다. 안정화 심도 토양과 상부복토, 하부오염토 간의 상관관계를 확인한 결과, 안정화 심도 토양에서 중금속의 농도가 높게 측정되었다. 그리고 풍정 광산에서는 안정화 처리 심도 토양이 하부오염토와 유사한 특성을, 점동, 서성 광산에서는 안정화 심도 토양이 상부복토와 유사한 특성을 나타내었는데 이는 점동, 서성 광산 주변 상부복토의 생태기능상태가 좋지 않을 수 있음을 시사한다.
1. 서 론현재 국내에 분포하는 개발광산은 총 5,396개(금속광산 2,166개)이며, 이 중 휴지광산은 122개, 폐광산은 4,681개로 약 87%에 해당하는 광산이 휴·폐광 상태이다[1]. 특히 폐금속 광산은 과거 채광, 선광, 제련 과정 등으로 인해 배출된 비소, 카드뮴, 납 등의 광산 폐기물이 광산 주변에 그대로 방치되고 있어 강우나 강풍에 의해 광산 하부의 농경지와 수계의 환경오염을 지속적으로 일으키고 있다[2,3]. 휴·폐금속광산 지역의 오염토양에 대한 토양개량사업은 1990년대 중반 이후 시행되어 왔으며 산업자원부, 환경부 등에서 담당하고 있다[4]. 산업자원부는 토양의 오염물질에 대한 안정화/고형화에, 환경부는 처리된 토양의 사후 처리에 중점을 맞춰 사업을 시행하고 있다[4].
다양한 폐석 및 광미, 오염부지의 처리기술이 소개되어 연구되고 있으나[4~6] 국내에서는 효과적인 복원기술이 미비하여 단순 복토에 의존하거나 일부 광산에는 단순 환경처리 시설을 설치하는 수준에 머무르고 있다[3,7]. 특히 국내에서는 다양한 안정화제(석회, 제강슬래그, 제올라이트 등)를 적용하여 안정화하는 연구가 활발히 진행되어 왔으며[8~10], 이에 따라 단순 복토와 석회 물질 등과 같은 토양 개량제를 이용한 공법을 사용하고 있다[11]. 그러나 이는 심부 오염물질의 상승, 반입 복토의 특성에 따른 지화학적 변화, 토양 개량제의 효율 지속성 등과 같은 문제점을 지닌다[11].
토양개량사업을 마친 토양의 상부에서는 작물의 재배가 이루어지는데, 이 과정에서 오염물질이 고정되어있는 안정화 층은 환경조건의 변화에 노출되고 지화학적 변화를 겪게 되며, 이에 따른 중금속의 용출 및 이동이 가능하다. 따라서 토양개량사업을 마친 토양에 대한 질(quality) 평가 등의 사후 관리는 반드시 필요하다. 토양의 질을 평가하는 방법은 물리화학적으로 pH, 중금속 농도 등 환경 인자의 농도를 측정하는 방법[12~14]과 생물학적으로 생물 인자를 이용한 방법이 있다[15~17].
특히 생물 인자는 환경에 민감하게 반응할 뿐만 아니라 토양의 생태기능(ecological function)과도 연관된다[16]. 뿐만 아니라 생물학적 방법은 실제 토양의 생태계를 직접적으로 평가할 수 있는 방법으로, 토양의 생태기능상태(ecological functional state)를 평가할 수 있는 가장 좋은 방법이다. 생물학적인 방법은 지렁이와 같은 지표 생물을 이용하는 독성학적 방법[16,18], 식물을 이용하는 방법[19,20], 그리고 미생물을 이용한 방법[15,21] 등이 있다. 미생물은 생태계의 기본적인 구성요소이지만 분해자(decomposer)로서의 중요한 기능을 담당하고 있으며, 토양의 생태적 다양성과 복잡한 상호작용에도 불구하고 토양 생물의 약 75%를 차지한다[22]. 따라서 토양의 가장 근본적인 건강을 평가하기 위해서는 토양 내 미생물의 건강성을 평가하여야 한다[22,23].
토양의 질을 실질적으로 평가하기 위해서는 물리화학적 방법 또는 생물학적 방법을 개별적으로 이용하는 것 보다 이들을 결합한 종합적인 분석이 필요하다. 따라서 본 연구에서는 토양의 이화학적 성질인 pH, CEC, 유기물 함량과 중금속 농도를 측정하고, 생물학적 성질인 미생물 효소활성도와 비소환원유전자를 정량하고 이를 기반으로 다변량 통계분석으로 모든 데이터를 분석하여 토양 생태기능상태를 평가하고자 하였다.
2. 실험방법2.1. 대상 시료 채취실험 대상 시료로 경상북도 봉화군 풍정 광산, 전라남도 광양시 점동 광산, 충청남도 서산시 서성 광산 인근의 안정화 처리된 토양과 오염 토양을 확보하였다(2014년 채취 실시, Fig. 1). 풍정 광산 인근에서는 안정화 처리된 890-1답 토양과 처리가 되지 않은 817-1전 오염 토양(Fig. 1(a)), 점동 광산 인근에서는 안정화 처리된 317-1답 토양과 처리가 되지 않은 228-4답 오염 토양(Fig. 1(b)), 서성 광산 인근에서는 안정화 처리된 293-8답 토양과 처리가 되지 않은 293-8답 2지구 하부토양(Fig. 1(c))을 각각 채취하였다. 실험군 토양은 각 광산 별로 3 지점(P1, P2, P3)을 선정하여 굴착기로 심도 120 cm까지 굴착하였으며, 20 cm의 심도마다 토양시료를 채취하였고, 대조군 토양(오염토양 및 비오염토양)은 표토(0~20 cm)를 채취하였다. 서성광산은 환토법 안정화 처리를 하였는데 상부 40 cm 삭토 후 심토 20 cm를 안정화 처리한 후에 40 cm 복토하였다(2009년). 점동 (2010년) 및 풍정광산(2011년)은 복토법 안정화 처리를 하였으며 심토 20 cm, 30 cm 안정화 후에 각각 상부에 40 cm, 30 cm 복토하였다. 따라서 세 광산 모두 (30)40~60 cm 심도지점 부분에 안정화 처리가 되어 있는 상태이다. 이화학적 분석을 위한 토양은 샘플 별로 약 2 kg 이상 확보하였으며 빛이 들지 않는 상온 조건에서 5~10일 동안 자연건조 시켰다. 건조과정에서 토양을 균질화하기 위해 3회/일, 30분/회 교반을 실시하였으며, 건조가 완료된 토양 시료는 점토질을 잘게 부수기 위해서 원판 분쇄기를 사용하여 분쇄하였다. 그 후 표준 체를 사용하여 각각 100 mesh 이하와 10 mesh 이하의 시료로 각각 체질하여 분석용 시료로 준비하였다. 체질이 완료된 시료는 화학적 용출을 통한 이동성평가 시료와 생물학적 이용도 평가 시료로 나누어 폴리비닐백에 담아 보관하였다. 미생물학적 분석을 위한 토양은 별도의 전처리 없이 -20℃에 보관하였다.
2.2. 이화학적 특성 분석토양의 기본 성상을 파악하기 위하여, 이화학적 특성을 분석하였다. 토양 함수율, pH, 양이온 교환능력(Cation exchange capacity, CEC)과 강열감량(Loss of ignition, LOI)을 이용한 유기물 함량을 측정하였다. 토양 함수율과 pH는 각각 1 g, 5 g의 토양을 이용하여 토양오염공정시험법[24]에 따라 측정하였다. pH는 Orion 5 star pH 미터(Thermo scientific, 미국)를 이용하여 측정하였다. 양이온 교환능력은 10 mesh 이하로 체질된 시료 약 0.5 g을 1 mole/L sodium acetate 용액과 에탄올을 이용하여 세척하고, 1 mole/L ammonium acetate 용액을 넣고 원심분리하여 상등액을 취해 분석하였다. 양이온교환능력(meq/100 g) 측정을 위해 건조토양을 1 moles/L sodium acetate (CH3COONa, Sigma-aldlich)를 이용하여 Na로 포화시켰다. 이후 1 moles/L ammonium acetate (NH4CH3CO2, Sigma-aldlich) 용액을 가하고, 이때 탈착된 Na를 유도결합플라즈마발광분석기(ICP-OES, Optima 5300DV, PerkinElmer, USA)로 분석하고 이를 이용하여 양이온교환능력을 계산하였다. 토양 내 LOI를 이용한 유기물 함량은 10 mesh 이하로 체질된 시료 약 15 g을 사용하였으며 ASTM D7348 [25]의 방법을 사용하였다.
2.3. 중금속 전함량 및 비소 화학종(speciation) 분석토양 내 중금속의 전함량을 측정하고자 토양오염공정시험법[24]에 따라 중금속(As, Cd, Cu, Ni, Pb, Zn)에 대한 왕수 분해를 실시하였다. 건조 후 체질이 완료된 토양시료(100 mesh 이하) 0.25 g에 왕수(HNO3 : HCl = 1 : 3) 4 mL을 주입한 후, 마이크로파 분해법을 이용하여 용출하였다. 반응 후 3차 증류수 6 mL을 주입하고 0.45 μm cellulose acetate filter로 필터링하여 중금속을 분석하였다. 모든 토양시료의 분석은 산분해 전처리 과정부터 3반복 수행하였다. 분해액을 취하여 여과한 후 분석용 시료로 하였다. 전처리가 완료된 시료는 Optima 5300 DV ICP-OES (Perkin Elmer, 미국)와 7500 CE ICP-MS (Agilent, 미국)를 이용하여 분석하였다.
비소호흡유전자와 비소 3가, 비소 5가 농도 간 상관관계를 확인하기 위해 비소 화학종을 분석하였다. 건조된 토양시료 1.0 g에 50 mmole/L 인산완충용액(pH = 7.0) 20 mL를 넣고 95℃로 15분간 용출시킨 뒤 10분간 환기시켜 마이크로파 분해법을 실시하였다. 토양을 포함한 모든 용액을 50 mL tube에 옮긴 후 원심 분리하여 상등액을 분리하고, 남은 시료에 5 mL의 증류수를 넣고 다시 원심 분리하여 두 용액을 하나로 합쳤다. 전처리를 마친 용액을 증류수를 사용하여 최종 액량을 50 mL로 한 뒤, 7500 CE ICP-MS (Agilent, 미국)를 이용하여 추출 농도를 측정하고, 이 용액을 LC-SAX (Agilent, 미국)를 통과시켜 비소 3가 농도로, 나머지 농도를 비소 5가 농도로 분석하였다.
2.4. 효소활성도 측정효소활성도 평가법은 카탈라아제(catalase), 탈수소효소(dehydrogenase), 베타글루코시다아제(β-glucosidase) 등과 같은 대표적인 생체 효소를 이용하여 토양 내의 미생물이 갖는 효소활성도를 평가하는 것으로, 토양의 생태기능상태가 높을수록 효소활성도가 높아지는 상관관계를 갖는 것으로 알려져 있다[26~28]. 그 중에서도 본 연구에서는 그 상관관계가 보다 정확한 것으로 알려진[29] 베타글루코시다아제의 활성도를 정량하였다.
본 연구에서는 토양 내 베타글루코시다아제 활성도 평가를 위하여 QuantiChrom™ β-Glucosidase Assay Kit (BioAssay Systems, 미국)를 사용하였다. 본 키트는 특별한 전처리 없이도 β-Glucosidase를 이용하여 샘플의 생물학적인 효소 활성도를 평가할 수 있도록 고안된 것이다. 냉동하여 보관하였던 샘플을 상온에서 자연 해동시켜 녹이고, 토양 0.5 g에 50 mmole/L의 인산완충용액(pH = 7.0) 0.5 mL를 넣고 vortex한 뒤 상등액을 취하여 해당 키트에 사용하였다. 0.1 mmole/L의 반응용액(working reagent, assay buffer와 β-NPG substrate의 혼합용액)를 매뉴얼에 따라 적절히 제조하여 이를 상등액과 혼합하여 405 nm에서 Optizen 2120UV Plus 흡광광도계(Mecasys, 한국)를 이용하여 흡광도를 측정하고 아래의 식을 이용하여 효소활성도를 계산하였다.
위의 식에서 ODt=0과 ODt=20은 각각 토양 샘플에서 인산완충용액(pH = 7.0)을 이용하여 추출한 상등액과 반응용액를 혼합한 직후와 20분 후에서의 흡광도를 의미한다. ODcal은 키트 내에 보정용으로 들어있는 calibration 용액의 흡광도를, ODH2O는 3차 증류수의 흡광도를 의미한다. 위의 식에서 U은 키트에서 제시하고 있는 단위이며, 1 U은 키트에 포함되어 있는 기질인 파라니트로페놀(paranitrophenol, PNP) 1 µmole을 1분 만에 분해하는 효소활성도를 의미한다. 상등액의 부피와 시료건조중량은 각각 단위환산을 위하여 사용하였으며, 상등액의 부피는 시료 내의 효소를 추출하는 데 사용하는 인산완충용액은 0.5 mL로 일정하게 사용하였다.
2.5. 토양 샘플 DNA 추출 및 비소 호흡 유전자 정량특정 중금속을 이용하여 생존할 수 있는 미생물의 양을 정량하기 위하여 본 연구에서는 최근 전세계적으로 만성 노출에 의한 독성 때문에 관리의 중요성이 강조되고 있으며 본 연구의 3개 대상 광산에서 모두 농도가 높아 주요 오염 물질로 존재하는 비소를 선택하였다. 안정화 처리 된 토양 내에 존재하는 비소 호흡종을 정량하기 위한 분석 방법으로는 qPCR (quantitative polymerase chain reaction)을 사용하였다. 목적 유전자는 ArrA를 채택하였으며 이는 비소를 호흡 기작에 이용하는 미생물의 유전체 DNA에 존재한다 [30,31]. 비소호흡환원에 관련된 세균은 이 작용을 통해 5가 비소화합물을 3가 비소화합물로 환원시키는 과정에서 에너지를 얻으며 이때 사용되는 효소는 arsenate respiratory reductase (arr) 라고 알려져 있고, 이 유전자는 비소호흡활성의 지표로 다양한 연구에서 사용되어 왔다 [30~32]. 특히 5가 비소에 비해 3가 비소가 이동성과 독성이 높기 때문에 토양에서 ArrA가 많이 검출된다는 것은 비소오염토양의 생태적인 기능 상태가 악화됨을 의미한다. 따라서 ArrA의 정량 분석은 중금속 오염 토양 및 안정화 처리 토양의 생태 건강성을 평가할 수 있는 정량적 지표라고 간주되어 본 연구에 사용하였다.
약 0.5 g(습식 무게) 채취된 토양시료로부터 Power soil DNA isolation kit (MO BIO Laboratories, 미국)를 이용하여 유전체 DNA를 추출하였고, 추출된 DNA는 전기영동으로 확인하고, Nanodrop 2000 흡광광도계(Thermo Scientific, 미국)을 이용하여 DNA의 농도(OD260)와 순도(OD260/OD280)를 측정하였다. 토양 샘플에서 추출한 DNA로부터 비소호흡유전자를 정량하기 위해 qPCR (quantitative polymerase chain reaction) 분석을 실시하였다. 표준곡선 작성을 위해 비소호흡유전자(ArrA)를 가지고 있다고 알려진 박테리아 중 Bacillus selenitireducens종[30,31] 의 DNA를 사용하였으며, 이는 B. selenitireducens의 MLS10 (ATCC 700615D-5TM)종으로부터 분리된 것이다. 또한 문헌을 통해 [31] ArrA 유전자를 증폭하는 것으로 알려진 PCR 프라이머 1쌍(HAArrA-D1, forward, 5’-CCGCTACTACACCGAGGGCWWYTGGGRNTA-3’, HAArrA-G2, reverse, 5’-CGTGCGGTCCTTGAGC TCNWDRTTCCACC-3’)을 제작하였다(바이오니어, 한국). 이 프라이머들을 각각 10 µmole/L로 준비하여 각 1.5 µL씩 사용하여 표준물질과 샘플의 ArrA 유전자 증폭을 위해 PCR 수행에 사용하였다. PCR의 수행 온도 조건은 95℃에서 5분간 predenaturation, 94℃에서 30초간 denaturation, 54℃에서 30초 동안 annealing, 72℃에서 30초간 extension 시키는 과정을 거치며 이를 40 cycles 반복했다. 그 후 final extension을 85 ℃에서 10초 동안 유지하였고, 증폭이 끝난 후에는 4℃로 유지시켰다.
PCR을 통해 증폭을 마친 표준물질과 샘플의 DNA를 이용하여 qPCR을 수행하였다. 10 µL의 2 X QN SYBR Green real-time PCR master mix 와 2 µmole/L의 QN ROX Dye, 그리고 forward, reverse 프라이머를 각각 1.4 µL씩 혼합하고, 각 샘플 주형 3 µL를 포함하여 전체 반응량이 20 µL가 되도록 하였다. qPCR 수행 온도 조건은 95℃에서 2분간 predenaturation, 95℃에서 5초 동안 denaturation, 4℃에서 30 초간 annealing과 extension을 40 cycles 반복했다. 그 후 dissociation을 위하여 95℃에서 15초, 60℃에서 30초, 95℃ 에서 15초 동안 시행하였다.
2.6. 다변량 통계분석중금속 농도, pH, CEC, LOI의 이화학적 분석결과와 토양의 효소활성도, ArrA 유전자 정량결과의 생물학적 미생물 특성은 다변량 통계분석(Multivariate statistical analysis) 을 통하여 비교 분석하였다. 다변량 통계분석 중에서도 본 연구에서는 주성분 분석(Principal component analysis, PCA)을 이용하였으며, 이후 분석을 위하여 CANACO 1.4.5 버전 (Microcomputer Power, 미국)을 사용하였다. 프로그램에 이용하기 적합한 형태로 데이터를 변형하기 위해서 Wcanoimp 4.5.2 버전을 이용하였으며, 얻어진 그래프의 형태를 분석에 알맞은 형태로 변형하기 위해서 Canodraw 4.14 버전을 이용하였다. 각 샘플은 site로 도시되었으며, 이화학적 분석 결과 및 미생물학적 분석 결과는 species로 도시되었다.
3. 결과 및 고찰3.1. 토양의 이화학적 특성 분석토양개량사업을 마친 3개의 광산(풍정, 점동, 서성)의 주변 토양 60개(대조군 포함)에 대하여 관련 이화학적인 특성 (토양함수율, pH, CEC, 유기물 함량) 및 중금속 농도(As, Cd, Cu, Pb, Zn, Ni, Fe, Ca)를 분석하였고 그 결과를 Tables 1-3에 나타내었다. 전체적인 중금속 농도의 경향을 볼 때 서성 광산의 중금속 오염이 높았으며, 특히 몇몇 시료의 중금속 농도가 환경부에서 지정하고 있는 가 지역(농경지, 과수원 등) 기준 토양오염 우려기준과 대책기준을 현저히 초과하는 것을 확인할 수 있었다. 그에 비하여 풍정 및 점동 광산은 중금속 오염이 매우 심각한 상황은 아닌 것으로 나타났다.
함수율의 경우 풍정 광산의 토양에서 가장 낮은 값(13.98 ± 2.966%)을 보였으며, 점동 광산의 토양에서 가장 높은 값 (22.66 ± 5.710%)을 보였다. pH는 3개 광산 60개 샘플에서 모두 중성의 값을 나타냈으므로 단일 용출법의 적용 및 생물학적 분석 방법 등에 있어서 토양의 pH에 의한 영향은 무시할 수 있을 것으로 판단되었다. 양이온치환능력(CEC)의 평균치 역시 일반 토양에 비해 다소 높은 값을 나타내고 있으며 농경지 토양 내 높은 점토질 함량 및 유기물 함량 등에 의한 것으로 판단된다. 유기물 함량은 일반 토양에 비해 비교적 높게 나타났는데, 이는 시료 채취 장소가 농경지이기 때문인 것으로 사료된다. 또한 3개 광산의 상부복토에서 칼슘(Ca)과 철(Fe)의 농도가 대부분 높게 나타났는데, 이는 안정화제에 의한 것이 아니라 석회질 비료 또는 퇴비 등의 영향인 것으로 보인다.
풍정광산의 심도별 중금속 오염 상태(Table 1)는 아래와 같다. Reference ID는 풍정광산의 세 개의 지점과 심도를 보여 주는데 예를 들면 PJ-P1-20에서 PJ는 풍정광산을 의미하고 P1은 3개의 샘플링 지점의 한곳이며 20은 0~20 cm 심도의 토양을 의미한다. 심도별 중금속 농도를 비교해 본 결과 As, Cu, Pb, Zn의 경우 안정화 심도에 해당하는 40~60 cm 심도 토양에서 대체적으로 높은 중금속 분포를 보였다. 특히 PJ-P1-60, PJ-P3-80의 샘플에서 비소농도가 각각 36.51 mg/kg, 64.53 mg/kg으로 토양오염우려기준을 초과하여 안정화 처리를 하지 않은 오염 대조군 토양보다도 그 값이 높게 측정되었다. 이 외 대부분의 중금속 농도는 우려기준을 초과 하지 않는 범위로 존재하였다. 한가지 언급해야 할 부분이 다른 두 광산과는 달리 풍정광산의 경우 오염 대조군 토양이 안정화 처리된 답토양이 아닌 전토양이었다. 이는 직접 비교하기에는 토양의 특성이 다소 상이할 것으로 예상되었으나, 기본적인 이화학적인 특성은 다른 광산지점에 비해 크게 다르지 않은 것으로 나타났다.
두번째로 점동 광산의 결과는 Table 2에 나타내었다. 점동 광산은 다른 두 광산의 토양에 비해 중금속 농도가 평균적으로 낮게 측정되었다. 그러나 안정화 심도에 해당하는 40~60 cm의 토양에서는 As, Cu, Pb, Zn의 농도가 다른 심도에 비해 높게 측정되었다. 특히 JD-P3-60의 샘플에서 비소 농도가 28.87 mg/kg로 토양오염우려기준을 초과하였으며, JD-P1-60의 샘플에서는 카드뮴농도가 4.192 mg/kg로 우려 기준을 초과하였다. 이 외 대부분의 중금속 농도는 우려기준을 초과하지 않는 범위로 존재하였다.
마지막으로 서성광산의 결과는 Table 3에 나타내었다. 서성 광산은 다른 두 광산의 토양에 비해 중금속 농도가 평균적으로 가장 높게 측정되었다. 특히 독성이 높은 것으로 알려진 비소가 45.19 mg/kg~483.2 mg/kg로 다수의 샘플 (SS-P1-60, SS-P1-100, SS-P1-120, SS-P2-40, SS-P2-60, SS-P3-100)에서 토양오염대책기준을 초과하였다. 또한 납(Pb) 은 SS-P1의 20~120 cm, SS-P2의 40~120 cm, SS-P3의 80~120 cm 토양에서 토양오염대책기준을 초과하였고, 아연(Zn) 은 SS-P1의 40~120 cm, SS-P2의 40~120 cm, SS-P3의 80~ 120 cm 토양에서 토양오염대책기준을 초과하였다. 전체적 으로는 SS-P1, SS-P3 지점에서는 하부오염토(80~120 cm)에서 오염도가 높고, SS-P2의 경우 안정화 심도 직하부(60~80 cm)의 토양에서 오염도가 높은 것으로 나타났다. 서성 광산의 경우 다량의 샘플에서 토양오염대책기준을 초과한 중금속 농도를 나타내 다른 두 광산 주변 토양보다 그 오염도가 높은 것으로 나타났다. 따라서 이에 따른 추가적인 분석 및 관리가 필요할 것으로 사료되었다.
3.2. 토양 내 효소활성도 분석 결과심도별 효소활성도 측정 결과 3개 광산, 3개 지점에서 채취한 총 9개의 안정화 심도 토양 중에서 풍정 P1, 점동 P1, 서성 P3를 제외한 6개의 시료에서 효소활성도가 매우 낮게 측정되었다. 이를 통해, 안정화 심도 토양의 생태기능상태가 낮은 것임을 유추할 수 있다. 심도프로파일에 따른 광산별 효소활성도에 대한 자세한 분석결과를 아래에 나타내었다.
풍정 광산 인근 토양 실험 결과 전체 심도에서 토양 효소 활성도는 평균 175.4 ± 130.2 µmole PNP/g dry soil·hr로 나타났으며, 지점별로 봤을 때는 P1의 효소활성도가 평균 218.0 ± 120.3 µmole PNP/g dry soil·hr로 가장 높게 나타났다(Fig. 2(a)). 심도별로 봤을 때는 80~100 cm의 심도에서 평균 333.7 ± 109.3 µmole PNP/g dry soil·hr로 가장 높은 값을 나타내어 토양의 기능적인 상태가 높은 것을 알 수 있었 다. P1에서는 안정화 상부 토양인 P1-40에서 가장 활성도가 낮은 값을 나타냈으며(Fig. 2(a)), P2에서는 안정화 처리 심도 토양인 P2-60와 그 하부 토양인 P2-80에서 그 값이 가장 낮게 나타났다(Fig. 2(b)). P3에서는 안정화 처리 심도 토양인 P3-60에서 효소활성도가 0 µmole PNP/g dry soil·hr로 그 기능적인 상태가 매우 낮은 상태임을 확인할 수 있었다 (Fig. 2(c)).
점동 광산 인근 토양의 효소활성도는 평균 39.09 ± 44.90 µmole PNP/g dry soil·hr로 나타나 다른 두 광산 인근 토양 보다 효소활성도가 10배 이상 낮게 측정되었다(Fig. 2(d)~ 2(f)). 지점별로 봤을 때는 P1의 효소활성도가 평균 60.60 ± 60.15 µmole PNP/g dry soil·hr로 가장 높게 나타났고, 심도 별로 봤을 때는 80~100 cm의 심도에서 평균 67.95 ± 55.59 µmole PNP/g dry soil·hr로 가장 높은 값을 나타내었다(Fig. 2(d)). P1에서는 최하부 토양인 P1-120에서 가장 활성도가 낮은 값을 나타냈으며, P2에서는 안정화 처리 심도 토양인 P2-60에서 효소활성도가 0 µmole PNP/g dry soil·hr로 토양 의 기능적인 상태가 매우 낮은 상태임을 확인할 수 있었다 (Fig. 2(e)). P3에서는 표토인 P3-20과 안정화 심도 하부 토양인 P3-80에서 효소활성도가 0 µmole PNP/g dry soil·hr로 그 기능적인 상태가 매우 낮은 상태임을 확인할 수 있었다 (Fig. 2(f)).
서성 광산 인근 토양의 효소활성도는 평균 468.3 ± 664.8 µmole PNP/g dry soil·hr로 세 광산 중 가장 높게 나타났으며, 지점별로 봤을 때는 P3의 효소활성도가 평균 948.9 ± 920.9 µmole PNP/g dry soil·hr로 가장 높게 나타났다(Fig. 2(i)). 심도별로 봤을 때는 40~60 cm의 심도에서 평균 849.5 ± 1,399 µmole PNP/g dry soil·hr로 가장 높은 값을 나타내어 토양의 기능적인 상태가 높은 것을 알 수 있었으나, 큰 표준편차를 나타내었다. P1에서는 표토 토양인 P1-20와 최하부 토양인 P1-120에서 활성도가 0 µmole PNP/g dry soil·hr로 측정되었으며(Fig. 2(g)), P2에서는 안정화 처리 심도 토양인 P2- 60에서 그 값이 가장 낮게 나타났다(Fig. 2(h)). P3에서는 안 정화 처리 심도 토양 상부에서 효소활성도가 1,000 µmole PNP/g dry soil·hr 이상의 값을 나타내었고, 안정화 하부 토양에서 역시 그 값이 크게 측정되었다(Fig. 2(i)). 하지만 최하부 토양인 P3-120에서 효소활성도 값이 0 µmole PNP/g dry soil·hr로 그 값이 측정되어 그 기능적인 상태가 매우 낮은 상태임을 확인할 수 있었다.
3개 광산에 대한 효소활성도 실험 결과 각각의 비오염 토양(대조군, PJ-NC, JD-NC, SS-NC)에서는 효소활성도가 높게 측정되었고(454.9, 300.1, 568.3 µmole PNP/g dry soil·hr), 오염 토양(대조군, PJ-Cont, JD-Cont, SS-Cont)에서는 효소 활성도가 모두 0으로 측정되었다(0, 12.41, 0 µmole PNP/g dry soil·hr). 효소활성도의 값이 토양 내에 존재하는 미생물의 양과 일반적으로 비례하므로 대조군을 대상으로 한 오염도 증가에 따른 효소활성도 감소는 본 실험방법의 신뢰성을 보여주는 일례라 할 수 있다. 그러나, 효소활성도의 이러한 경향이 모든 시료에 적용되는 것은 아니었는데 일례로 3개 광산의 모든 시료의 중금속 농도와 효소활성도 간의 선형적인 상관관계를 분석해본 결과 통계적으로 유의한 상관 관계는 확인할 수 없었다(R2 = 0.196, 0.133, 0.001 풍정, 점동, 서성 광산). 그 이유는 효소활성도 측정법이 흡광도를 이용하는 방법인 만큼 토양의 복잡한 매트릭스나 토양의 부유물질에 의해 그 값의 표준 편차가 크게 나타날 수 있기 때문일 것으로 예상되었다.
효소활성도 실험은 그 과정이 간편하고 신속하다. 따라서, 토양개량사업을 마친 토양의 사후관리를 위한 토양관리 정책에 적용하기 위하여 안정화 처리 토양에 대한 스크리닝 기법으로 활용하기에 좋을 것으로 사료되었다. 하지만 다양한 토양의 성상에 의해 쉽게 영향을 받아 결과가 달라질 수 있으며 Fig. 2에서 관찰되는 것처럼 반복수 간의 큰 표준편차를 보이는 등의 단점 또한 존재하므로, 토양의 질 평가를 위한 단일 분석보다는 다른 분석법과 병행하는 방법이 좋을 것으로 예상된다.
3.3. 비소 화학종(speciation) 및 비소호흡 유전자 정량 결과비소호흡 유전자로 알려진 ArrA 유전자는 비소의 양이 높은 환경에서 비소 5가를 비소 3가로 환원시키는 유전자로 알려져 있다 [31,33]. 이 유전자는 독성이 높은 비소 5가를 환원시킬 수 있는 능력을 가지고 있기 때문에 비소 독성에 대한 내성을 가진 미생물 종이 보유하고 있는 유전자로 선행 연구에서 밝혀진 바 있다. 따라서 ArrA 유전자 양이 높게 측정된 경우 비소 5가를 비소 3가로 환원시킬 수 있는 유전자를 가진 미생물이 많다는 뜻으로, 환경에서 높은 독성을 지닌 비소 3가의 양이 더 많아질 수 있음을 의미한다. 따라서 ArrA 유전자가 높게 측정된 토양에서는 비소의 독성으로 인해 토양의 생태기능상태가 낮아질 수 있다. 본 연구에서는 각 광산 지점별 비소 화학종과 유전자의 추이 간 상관관계를 확인하고, 심도별로 안정화 심도에서 비소 농도와 ArrA 유전자 간 연관성이 있는지를 확인하여 ArrA 유전자를 토양의 생태기능평가에 이용할 수 있는지 확인하고자 시료의 ArrA 유전자를 정량하였다. 총 60개(대조군 포함)의 시료에 대하여 비소호흡 유전자와 비소 화학종을 정량하였고, 그 결과를 Fig. 3에 나타내었다. Fig. 3의 (a), (b), (c)는 각각 풍정 광산의 P1, P2, P3의 분석 결과, (d), (e), (f)는 점동 광산의 P1, P2, P3의 분석 결과, (g), (h), (i)는 각각 서성 광산의 P1, P2, P3의 분석 결과이다.
풍정 광산의 ArrA 유전자의 양은 P1, P2, P3 세 곳 모두 상부복토에서 하부오염토보다 높게 측정되었다(Fig. 3(a)~3(c)). 상부복토는 농경에 직접적으로 이용되는 토양으로 실질적으로 토양의 기능적인 상태가 좋아야 하는 부분임에도 불구하고, 앞서 시행한 효소활성도 결과와 ArrA 유전자 정량 결과 모두 생태기능상태가 낮음을 나타내 토양개량사업 이후의 사후 관리가 필요하다는 것을 확인할 수 있다. P1에 서는 비소 5가의 심도 별 추이와 ArrA 유전자의 심도 별 추이가 정확하게 일치하였다(Fig. 3(a)). ArrA 유전자는 비소 5가를 이용하는 효소를 발현하는 유전자로, 이는 qPCR 결과가 토양의 상태를 정확하게 대표하고 있음을 확인 할 수 있는 결과이다. 또한, 토양 오염 우려기준을 초과했던 안정화 심도(30~60 cm)에서 ArrA 유전자의 양이 가장 높게 측정 되어 비소 5가의 양이 많은 심도에서 ArrA 유전자를 지닌 미생물이 많이 분포하는 것을 확인할 수 있다. P2에서는 ArrA 유전자의 양이 가장 높게 측정된 P2-40에서 비소 5가와 3가 농도가 모두 높게 측정되었고, 대부분의 심도에서 그 추이가 일치하였다(Fig. 3(b)). P2-40은 복토에 해당하는 샘플로, 건강한 토양으로 복토된 부분임에도 불구하고 그 생태 적인 기능이 낮은 것으로 판단되었다. 이는 앞서 시행한 효소활성도 결과와 일치하는 결과로, 안정화 상부 토양의 기능적인 상태가 좋지 않음을 의미한다. P3에서는 예외적으로 안정화 상부 토양에서보다 하부 토양에서 비소 5가와 3가의 농도가 높게 나타났으나, ArrA 유전자는 상부에서 더 높게 측정되었다(Fig. 3(c)).
점동 광산은 전체적으로 ArrA 유전자의 양과 비소 5가, 3가 농도의 심도 별 추이가 크게 일치하지 않는 것으로 나타났다(Fig. 3(d)~3(f)). P1에서는 안정화 심도에 해당하는 P1-60에 서 ArrA 유전자의 양이 5.6 × 105 ± 3,638 gene copy number/g dry soil로 다른 지점에 비해 10배 이상 높게 나타났으며, 대조군 토양의 ArrA 유전자 양보다도 3배 이상 높게 측정되었다(Fig. 3(d)). 하지만, 상부복토 및 하부오염토에서는 모두 ArrA 유전자의 양이 낮게 측정되었다. P2에서는 하부오염토에서 ArrA 유전자의 양이 상부복토에서보다 높게 측정 되었다(Fig. 3(e)). 특히 P2-80 샘플에서 ArrA 유전자의 양 이 6.2 × 106 ± 3.2 × 105 gene copy number/g dry soil로 측정 되어 점동 광산 인근 토양 샘플 중 가장 큰 값을 나타내었다. 이는 비소 농도가 안정화 심도 토양에서 가장 높게 나타난 것과는 상이한 결과이다. P3에서 비소 농도는 안정화 심도 상부보다 하부에서 높게 나타났으나, ArrA 유전자의 양은 표토에서 1.1 × 106 ± 1.2 × 105 gene copy number/g dry soil로 가장 높은 값을 나타내었다. 하지만 다른 두 지점에 비해 평균적으로 낮은 값을 나타내었다(Fig. 3(f)).
서성 광산은 다른 두 지점에 비해 비소의 농도가 평균 83.80 ± 123.70 mg/kg로 높게 나타났으나, 이에 반해 ArrA 유전자의 양은 평균 87,491 ± 61,599 gene copy number/g dry soil 로 낮게 나타났다(Fig. 3(g)~3(i)). P1에서는 심도별로 ArrA 유전자의 변화추이를 확인할 수 없었다(Fig. 3(g)). P2에서 는 ArrA 유전자의 양이 안정화 처리 심도 상부 토양보다 하부 토양에서 높게 측정되었으며, 비소 5가와 3가 양 역시 하부에서 높게 측정되었다(Fig. 3(h)). 특히 P2는 다른 두 지점보다 비소 5가의 양이 높게 측정되었다. P3에서는 특징적 으로 P3-100 샘플에서 ArrA 유전자의 양이 2.8 × 105 ± 57,614 gene copy number/g dry soil로 가장 높게 측정되었다(Fig. 3(i)). 하지만 전체 지점에서 오염 대조군 토양의 ArrA 유전 자 양보다 낮게 측정되었으며, 심도 별 ArrA 유전자의 추이와 비소 5가, 3가 농도의 추이의 상관성을 찾기 어려웠다.
본 실험에서 사용한 qPCR을 이용한 ArrA 유전자 정량 결과는 특정 중금속(비소)을 이용한 기작에 대한 구체적 정보를 제공할 수 있었다. 뿐만 아니라 효소활성도 결과에 비해 표준 편차가 매우 작게 나타나 토양의 복잡한 매트릭스에서도 저해작용 없이 정량 평가를 수행할 수 있음을 확인할 수 있었다. 또한 한 번에 여러 개의 시료를 분석할 수 있기 때문에 그 분석 과정이 신속했다. 하지만, 일부 지점에서 비소 화학종과 ArrA 유전자의 정량 추이가 일치하지 않았기 때문에 이 방법 역시 토양의 질 평가를 위한 단일 분석보다 는 다른 분석법과 병행하는 방법이 좋을 것으로 예상되었다.
토양의 생태기능상태를 평가하는 방법은 여러 가지 측면 에서 고려해야 하며, 한가지 요인으로 평가할 수 없다. 35) 따라서 토양개량사업을 마친 토양의 사후관리를 위한 토양관 리 정책에 적용하기 위해서는 앞서 시행한 모든 실험의 결 과를 종합하여 결론을 내려야 한다.
3.4. 다변량 통계분석 결과다변량 통계분석 방법을 이용하면 결과에 영향을 미치는 여러 가지 요인을 몇 가지 성분으로 추출하여 설명하고 예측 할 수 있다. 본 연구에서는 연구 대상 지역별로 각각 구분하여 토양 중금속 및 이화학적 결과, 효소 활성도 결과, ArrA 유전자 정량 결과를 결합한 다변량 통계분석을 실시하였다. 세 지역 모두 주성분 2개를 각각 추출할 수 있었으 며, 주성분 요인 1과 요인 2의 factor score를 2차원 평면상 에 나타내었다(Fig. 4~6).
풍정 광산 인근 토양의 특성은 제 1 주성분이 99.9%, 제 2 주성분이 0.10%로 전체(100.0%) 자료를 설명할 수 있는 것으로 나타났고, 각 샘플의 plot을 Fig. 4에 나타냈다. 주성분 분석 결과 주성분은 ArrA 유전자, Ca, Zn, Cu, Fe, As, Pb 농도, 효소활성도 정량결과였고, 샘플의 pH, LOI, CEC, 수분함량은 모두 기여율이 낮은 것으로 나타났다. 주성분 분석 결과 각 샘플의 plot을 살펴보면, 안정화 심도 토양은 하부 오염토와 grouping이 가능한 것을 확인해 볼 수 있다. 앞서 시행한 실험 결과와 비교해보면 효소활성도 결과는 P1, P2, P3 전 지점에서 안정화 심도 토양과 하부오염토가 grouping 이 가능하였고(Fig. 2(a)~(c)), ArrA 유전자 결과는 P2에서 안정화 처리 심도 토양과 하부 토양의 grouping이 가능하 였다(Fig. 3(b)).
점동 광산 인근 토양의 특성은 제 1 주성분이 100.0%로 전체 자료를 설명할 수 있는 것으로 나타났고, 각 샘플의 plot 을 Fig. 5에 나타냈다. 다변량 통계분석 결과 주성분은 ArrA 유전자, 효소활성도, Fe, Ca, As 농도였고, 샘플의 pH, CEC, 유기물 함량, 수분 함량은 모두 기여율이 낮은 것으로 나타났다. 주성분 분석 결과 각 샘플의 plot을 살펴보면, 안정화 심도 토양은 상부복토 토양과 grouping이 가능한 것을 확인 해 볼 수 있다. 앞서 시행한 실험 결과와 비교해보면 효소활성도 결과는 P1, P2 지점에서 안정화 심도 토양과 상부복토 간의 grouping이 가능하였고(Fig. 2(d), 2(e), ArrA 유전자 결과는 P2에서 안정화 심도 토양과 상부복토간의 grouping 이 가능하였다(Fig. 3(e)).
서성 광산 인근 토양의 특성은 제 1 주성분이 88.1%, 제 2 주성분이 10.9%로 전체자료의 99.9%를 설명할 수 있는 것으로 나타났고, 각 샘플의 plot을 Fig. 6에 나타냈다. 다변량 통계분석 결과 주성분은 ArrA 유전자, LOI, Cu, Ca, Fe, Ni, As, Cd, Pb, Zn농도였고 샘플의 효소활성도 정량 결과 는 기여율이 낮은 것으로 나타났다. 따라서 특징적으로 다른 두 광산에 비해 다양한 요소가 효소활성도와 ArrA 유전자 결과에 영향을 미치는 것으로 나타났다. 각 샘플의 plot을 살펴보면, 안정화 심도 토양은 상부복토와 grouping이 가능한 것을 확인해 볼 수 있다. 앞서 시행한 실험 결과와 비교해 보면 효소활성도 결과는 P1, P2, P3 전 지점에서 안정화 심도 토양과 상부복토가 grouping이 가능하였고(Fig. 2(g)~2(i)), ArrA 유전자 결과 역시 P1, P2, P3 전 지점에서 안정화 심도 토양과 상부복토가 grouping 가능하였다(Fig. 3(g)~3(i)).
PCA 분석 결과 3개 광산에서 모두 제 1 요인이 ArrA 유전자로 나타났다. 이는 중금속 농도 등의 이화학적 분석보다 미생물학적 분석이 샘플의 군집 형성에 큰 영향을 미친 다는 것을 의미한다. 하지만 이화학적 분석 결과 역시 주요 요인으로 나타나 토양의 질을 평가하려는 목적으로 생태기능상태를 분석하기 위해서는 이화학적 결과와 생물학적 결과를 복합적으로 시행해야 토양의 생태기능상태를 평가하는 데 활용할 수 있을 것으로 사료된다. 특히 중금속 농도가 높게 측정된 서성광산에서는 중금속 농도 역시 큰 영향을 미치는 것으로 나타났다. 풍정 광산에서는 안정화 심도 토양이 하부오염토와 이화학적 분석 결과와 미생물학적 분석 결과에서 유사한 양상을 나타낸 반면 상부복토는 오염도가 높은 심도인 안정화 심도 토양과 다른 양상을 나타내는 것으로 확인되어 상부복토의 생태기능상태가 나쁘지 않을 것 으로 예상되었다. 하지만 점동, 서성 광산에서는 안정화 심도 토양이 상부복토와 유사한 양상을 나타냈다. 이는 복토 의 생태기능상태가 좋지 않음을 시사하기 때문에 두 광산 인근 토양에 대해서는 실제 토양 내에 존재하는 미생물을 추출하여 직접적으로 미생물 군집 분석을 하는 등 추가적인 실험과 사후 관리가 필요할 것으로 예상되었다. 토양의 중금속 농도가 높을 경우, 토양 내 미생물의 효소활성도는 감소하기 때문에 중금속 농도결과와 효소활성도 결과는 반대 의 양상을 보여야 하며, 비소의 농도가 높을 경우 비소를 활용하여 호흡하는 미생물이 지닌 ArrA 유전자의 양은 높게 나타나기 때문에 비소 농도 결과와 ArrA 유전자 분석 결과 양의 상관관계를 보여야 한다. 예상과는 달리, 실제로 분석 결과 일부 지점에서는 일치하는 결과를 보였으나, 나머지 일부 지점에서는 일치하지 않는 결과를 보였다. 이는 높은 중금속 농도가 곧바로 토양 내 미생물에 영향을 미치는 것이 아닌 시간이 지남에 그 독성에 의해 미생물이 영향을 받는 것임을 예측할 수 있게 하는 결과이다. 따라서, 토양개량사업을 마친 토양의 중금속 농도가 안정화층에 고정되어 토양이 안정되었다고 해도 토양의 생태기능상태가 좋다고 볼 수는 없기 때문에 토양개량사업을 마친 토양에 대한 이화학적 분석 및 미생물학적 분석을 통한 사후 관리가 꼭 필요하다.
4. 결 론본 연구에서는 안정화 처리된 3개 폐광산(풍정, 점동, 서성 광산) 인근 토양에서 각각 3지점을 선정하고, 일반 미생물의 활성을 알 수 있는 효소활성도 측정 방법과 특정 유해 중금속(As) 호흡유전자를 지닌 미생물의 유전자를 정량 하여 각 지점의 생태기능상태를 평가하였으며 다음과 같은 결론 을 도출하였다.
안정화 심도 토양에서 중금속의 농도가 가장 높게 측정되었으며, 특히 서성광산 주변 지역에서 비소, 납, 아연 등 중금속의 농도가 환경부에서 정하는 토양오염우려기준과 토양오염대책기준을 초과한 값으로 나타났다. 이를 통해 안정화 심도에 오염물질이 고정 형태로 존재하는 것임을 확인 할 수 있었다.
미생물 효소활성도 결과 총 9개 지점 중 5개 지점에서는 안정화 심도 토양의 효소활성도가 낮게 측정되었으며, 비소 호흡유전자 정량 결과 일부 지점에서 비소 5가 농도와 비소 호흡유전자의 정량 결과의 추이가 일치하여 ArrA 유전자가 비소 5가를 이용하여 비소 3가로 환원시키는 역할을 하는 것을 확인할 수 있었다.
다변량 통계분석 결과 풍정 광산에서는 안정화 심도 토양이 하부오염토와 유사한 특성을 나타냈고, 점동, 서성 광산에서는 안정화 심도 토양이 상부복토와 유사한 특성을 나타냈다. 상부복토는 건강한 객토임에도 불구하고 오염도가 높은 안정화 심도 토양과 유사한 특성을 나타낸 것은, 농경에 직접적으로 이용되는 상부복토의 생태기능상태가 좋지 않음을 시사한다.
본 연구 결과 토양의 질을 평가하려는 목적으로 생태기능 상태를 분석하기 위해서는 이화학적 분석과 미생물학적 분석을 시행하여 융합적으로 결과를 해석해야 할 것으로 사료 된다. 또한, 이러한 융합적 평가는 토양개량사업의 사후관리를 위한 토양오염관리정책의 일환으로 사용할 수 있을 것 으로 예상된다.
상부복토의 생태기능상태가 낮게 나타난 지점에서는 작물 재배에 앞서 토양 내 오염물질을 제거하는, 보다 적극적인 개량사업이 필요할 것으로 사료된다. 본 연구에서 제언한 융합적 방법을 통해 지난 20년간 추진된 폐광산지역의 개량 정책을 평가한다면 향후 수립되는 토양오염관리정책의 방향을 설정하고 전략을 수립하는 데 초석이 될 것이다.
Acknowledgments본 연구는 환경부의 토양·지하수 오염방지기술개발사업인 GAIA (Geo-Advanced Innovative Action) Project의 지원 (GAIA #G114-00056-0403-1)을 받아 수행되었습니다. 또한 본 논문에서의 이화학적 분석은 광주과학기술원(GIST) 토양분석센터의 도움을, 토양 샘플링 과정은 경상대학교(GNU) 의 도움을 받아 이루어졌습니다.
Fig. 2.The quantification of β-glucosidase activity from the (a) P1 (b) P2 (c) P3 of Pungjeong mine samples, (d) P1 (e) P2 (f) P3 of Jeomdong mine samples, (g) P1 (h) P2 (i) P3 of Seosung mine samples. 
Fig. 3.The quantification of ArrA gene and arsenic concentration from the (a) P1 (b) P2 (c) P3 of Pungjeong mine samples, (d) P1 (e) P2 (f) P3 of Jeomdong mine samples, (g) P1 (h) P2 (i) P3 of Seosung mine samples. The closed circles mean arsenate concentrations, and the opened circles mean arsenite concentrations. 
Fig. 4.Principal component analysis between physicochemical data, biological data and samples from Pungjeong mine. Green dots mean samples from cover soils, red dots mean samples from stabilized soils, and blue dots mean samples from lower layer soils. 
Fig. 5.Principal component analysis between physicochemical data, biological data and samples from Jeomdong mine. Green dots mean samples from cover soils, red dots mean samples from stabilized soils, and blue dots mean samples from lower layer soils. 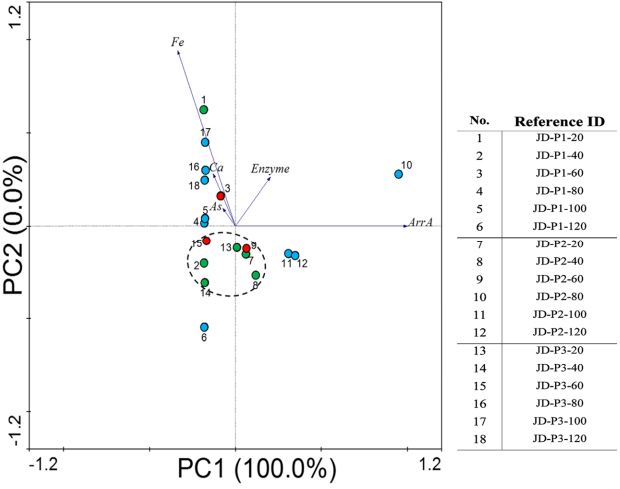
Fig. 6.Principal component analysis between physicochemical data, biological data and samples from Seosung mine. Green dots mean samples from cover soils, red dots mean samples from stabilized soils, and blue dots mean samples from lower layer soil. 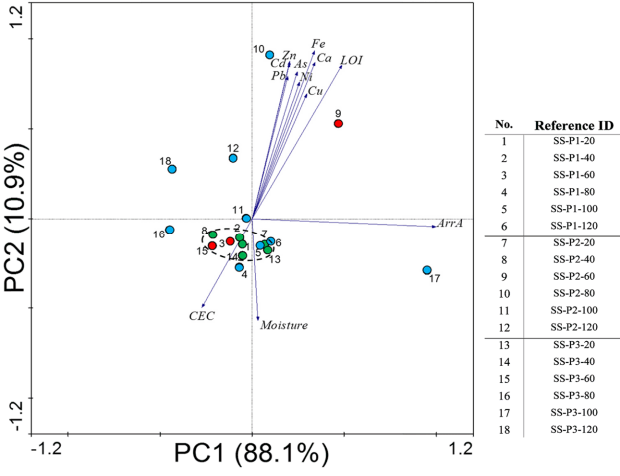
Table 1.Physicochemical properties of Pungjeong mine soils
Table 2.Physicochemical properties of Jeomdong mine soils
Table 3.Physicochemical properties of Seosung mine soils
References1. Mine Reclamation Corporation, The second stage of mine reclamation plan (year of 2012-2016)Ministry of Knowledge Economy(2011).
2. M. C.. Jung, J. S.. Ahn, H. T.. Chon, Environmental contamination and sequential extraction of trace elements from mine wastes around various metalliferous mines in Korea, Geosyst. Eng., 4, 50-60(2001).
3. M. C.. Jung, M. Y.. Jung, Y. W.. Choi, Environmental Assessment of Heavy Metals Around Abandoned Metalliferous Mine in Korea, Economic and Environ. Geol., 37(1), 21-33(2004).
4. Y. H.. Park, K. W.. Seo, Policy Suggestions for Soil Contamination Prevention and Management of Inactive or Abandoned Metal Mines, J. Korean Soc. Soil and Groundwater Environ., 11(3), 1-11(2006).
5. S. O.. Kim, S. H.. Moon, K. W.. Kim, A study on the removal of heavy metals from soils using electrokinetic soil processing and ion exchange membrane, Economic and Environ. Geol., 32(1), 43-51(1991).
6. J.-Y.. Kim, A. P.. Davis, K.-W.. Kim, Stabilization of available arsenic in highly contaminated mine tailings using iron, Environ. Sci. Technol., 37(1), 189-195(2003).
7. S. J.. Oh, S. C.. Kim, R. Y.. Kim, Y. S.. Ok, S. M.. Oh, J. S.. Lee, J. E.. Yang, Change of bioavailability in heavy metal contaminated soil by chemical amendment, Korean J. Soil Sci. Fertilizer., 45(6), 973-982(2012).
8. J.-H.. Son, H.. Roh, S.-Y.. Lee, S.-K.. Kim, G.-H.. Kim, J.-K.. Park, J.-K.. Yang, Y.-Y.. Chang, Stabilization of heavy metal contaminated paddy soils near abandoned mine with steel slag and CaO, J. Soil and Groundwater Environ., 14(6), 78-86(2009).
9. I.-H.. Koh, S.-H.. Lee, W.-S.. Lee, Y.-Y.. Chang, Assessment on the transition of arsenic and heavy metal from soil to plant according to stabilization process using limestone and steelmaking slag, J. Soil and Groundwater Environ., 18(7), 63-72(2013).
10. S.-J.. Oh, S.-C.. Kim, H.-S.. Yoon, H.-N.. Kim, T.-H.. Kim, K.-H.. Yeon, J.-S.. Lee, S.-J.. Hong, J.-E.. Yang, Evaluating heavy metal stabilization efficiency of chemical amendment in agricultural field: field experiment, Korean J. Soil Sci. and Fertilizer., 44(6), 1052-1062(2011).
11. J. H.. Kim, D. Y.. Chung, S. J.. Oh, R. Y.. Kim, J. E.. Yang, G. I.. Park, J. S.. Lee, S. C.. Kim, Determining soil quality of heavy metal contaminated agricultural field in Korea, Korean J. Soil Sci. and Fertilizer., 45(6), 1237-1241(2012).
12. J. L.. Smith, J. W.. Doran, Chap 10. Measurement and use of pH and electrical conductivity for soil quality analysisMethods for assessing soil quality, 169-185(1996). SSSA Special Publication, Soil Science Society of America, Madison, WI, USA.
13. J. W.. Doran, D. C.. Coleman, D. F.. Bezdicek, B. A.. Stewart, B. P.. Timothy, Defining soil quality for a sustainable environment, “Chap 1. Defining and assessing soil quality"1-21(1994).
14. S. H.. Schoenholtz, H.. Van Miegroet, J. A.. Burger, A review of chemical and physical properties as indicators of forest soil quality: challenges and opportunities, Forest Ecol. and Manage., 138(1), 335-356(2000).
15. Z.. Filip, International approach to assessing soil quality by ecologically-related biological parameters, Agric., Ecosystems & Environ., 88(2), 169-174(2002).
16. J. W.. Doran, M. R.. Zeiss, Soil health and sustainability: managing the biotic component of soil quality, Appl. Soil Ecol., 15(1), 3-11(2000).
17. J. D.. Knoepp, D. C.. Coleman, D. A.. Crossley Jr, J. S.. Clark, Biological indices of soil quality: an ecosystem case study of their use, Forest Ecol. and Manage., 138(1), 357-368(2000).
18. P. B.. Dorn, T. E.. Vipond, J. P.. Salanitro, H. L.. Wisniewski, Assessment of the acute toxicity of crude oils in soils using earthworms, microtox®, and plants, Chemosphere., 37(5), 845-860(1998).
19. D. L.. Jones, J.. Rousk, G.. Edwards-Jones, T. H.. DeLuca, D. V.. Murphy, Biochar-mediated changes in soil quality and plant growth in a three year field trial, Soil Biol. and Biochem., 45(2), 113-124(2012).
20. T. J.. Stohlgren, L. D.. Schell, B. V.. Heuvel, How grazing and soil quality affect native and exotic plant diversity in Rocky Mountain grasslands, Ecol. Appl., 9(1), 45-64(1999).
21. D.. Jordan, J.. Kremer, W. A.. Bergfield, K. Y.. Kim, V. N.. Cacnio, Evaluation of microbial methods as potential indicators of soil quality in historical agricultural fields, Biol. and Fertility of Soils., 19(4), 297-302(1995).
22. M.. Kim, J.-W.. Jung, K.. Nam, The Toxicity Assessment of Explosives Contaminated Soil using Soil Microbial Activity Tests, J. Soil and Groundwater Environ., 20(6), 37-45(2015).
23. D.. Ki, J.. Park, J, Lee, P.. Rho, A weak correlation of field-detemined soil microbial diversity with quantitative ecological map information and its methodological implication in estimation soil ecological quality, J. Korean Civil Eng., 27(6), 703-710(2007).
24. Ministry of Environment, Soil pollution process test standardwebbook.me.go.kr/DLi-File/NIER/09/018/5509908.pdf(2009).
25. ASTM International, Standard test methods for loss of ignition (LOI) of solid combustion residuesASTM D7348.
26. G.. Tyler, Heavy metal pollution and soil enzymatic activity, Plant and Soil., 41(2), 303-311(1974).
27. R. G.. Burns, Enzyme activity in soil: location and a possible role in microbial ecology, Soil Biol. and Biochem., 14(5), 423-427(1982).
28. T. R.. Knight, R. P.. Dick, Differentiating microbial and stabilized β-glucosidase activity relative to soil quality, Soil Biol. and Biochem., 36(12), 2089-2096(2004).
29. D.. Tica, M.. Udovic, D.. Lestan, Long-term efficiency of soil stabilization with apatite and Slovakite: The impact of two earthworm species (Lumbricus terrestris and Dendrobaena veneta) on lead bioaccessibility and soil functioning, Chemosphere., 91(1), 1-6(2013).
30. E.. Afkar, J.. Lisak, C.. Saltikov, P.. Basu, R. S.. Oremland, J. F.. Stolz, The respiratory arsenate reductase from Bacillus selenitireducens strain MLS10, FEMS Microbiol. Lett., 226(1), 107-112(2003).
31. D.. Malasarn, C. W.. Saltikov, K. M.. Campbell, J. M.. Santini, J. G.. Hering, D. K.. Newman, arrA is a reliable marker for As(V) respiration, Science., 306(5695), 455-455(2004).
32. T. R.. Kulp, S. E.. Hoeft, L. G.. Miller, C.. Saltikov, J. N.. Murphy, S.. Han, B.. Lanoil, R. S.. Oremland, Dissimilatory arsenate and sulfate reduction in sediments of two hypersaline, arsenic-rich soda lakes: Mono and Searles Lakes, California, Appl. and Environ. Microbiol., 72(10), 6514-6526(2006).
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||